
【题目】下列说法不正确的是( )
A.二溴乙烷和水、溴苯和水、硝基苯和水三对物质都能用分液漏斗进行分离
B.苯与甲烷都不能使酸性高锰酸钾褪色,而甲苯能使酸性高锰酸钾褪色,则苯环使得甲基活化
C.甲苯与足量![]() 加成的产物的一氯代物有5种同分异构体
加成的产物的一氯代物有5种同分异构体
D.在溴乙烷中加入适量的氢氧化钠溶液,加热一段时间,再滴入几滴硝酸银溶液,会有沉淀析出,则溴乙烷在碱性条件下能水解
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下进行如下反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组为测定空气中CO2的含量,进行了如下实验:
①配制0.1000mol·L-1和0.01000mol·L-1的标准盐酸。
②用0.1000mol·L-1的标准盐酸滴定未知浓度的Ba(OH)2溶液10.00mL,结果用去盐酸19.60mL。
③用测定的Ba(OH)2溶液吸收定量空气中的CO2。取Ba(OH)2溶液10.00mL,放入100mL容量瓶里加水至刻度线,取出稀释后的溶液放入密闭容器内,并通入10L标准状况下的空气,振荡,这时生成沉淀。
④过滤上述所得浊液。
⑤取滤液20.00mL,用0.01000mol·L-1的盐酸滴定,用去盐酸34.80mL。请回答下列问题:
(1)配制标准盐酸时,需用下列哪些仪器?____;
A.托盘天平 B.容量瓶 C.酸式滴定管 D.量筒 E.烧杯 F.胶头滴管 G.玻璃棒
(2)滴定操作中,左手____,右手____,眼睛____;
(3)Ba(OH)2溶液的物质的量浓度是____;
(4)过滤所得浊液的目的是____;
(5)此空气样品中含CO2的体积分数为____;
(6)本实验中,若第一次滴定时使用的酸式滴定管未经处理,即注入第二种标准盐酸,并进行第二次滴定,使测定结果____(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①I2(g)+H2(g)![]() 2HI(g) ΔH1=-9.48 kJ/mol
2HI(g) ΔH1=-9.48 kJ/mol
②I2(s)+H2(g)![]() 2HI(g) ΔH2=+26.48 kJ/mol
2HI(g) ΔH2=+26.48 kJ/mol
下列判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.I2(g)=I2(s) ΔH=-17.00 kJ/mol
C.固态碘的稳定性比气态碘的稳定性高
D.1 mol固态碘和1 mol气态碘分别与氢气完全反应,前者断裂的I—I键更多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
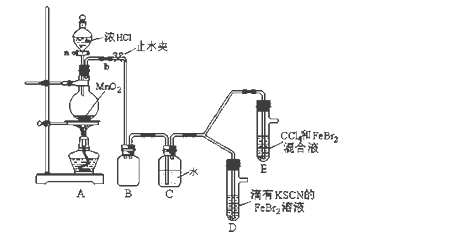
(1)①装置A中发生反应的离子方程式是_____________________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3 是一个可逆反应。
Fe(SCN)3 是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________溶液,若溶液颜色________,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释产生白色沉淀原因__________________、_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)

回答下列问题:
(1)按如图所示的装置连接完仪器,在加药品之前应该做的操作是______________
(2)装置A中液体试剂选用_____________________________,
(3)装置B的作用是___________________________________,装置C的作用是____________________________________,装置E中碱石灰的作用是____________________________________________,
(4)装置D中发生反应的化学方程式是______________________________________
(5)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为燃料的微生物燃料电池的结构如图所示。下列关于该电池的叙述不正确的是( )

A.该装置属于原电池
B.放电过程中,H+从负极区向正极区迁移
C.在电池反应中,每消耗1 mol氧气,理论上能生成11.2 L(标准状况)CO2
D.电池负极的电极反应式为C6H12O6+6H2O-24e-=6CO2↑+24H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业。在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。某校学生实验小组设计下图所示装置,制取该产品。D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
Ⅰ.可选用的药品有:
a.石灰石;b.饱和氯化钙溶液;c.6 mol/L盐酸;d.氯化铵;e.氢氧化钙
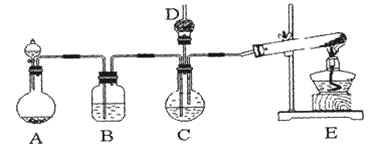
(1)A中制备气体时,所需药品是(选填字母序号)______________;
(2)B中盛有饱和碳酸氢钠溶液,其作用是______________________________;
(3)写出制取氨气的化学方程式__________________________________;
(4)在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式______________;
(5)检验D出口处是否有氨气逸出的方法是__________________________;
(6)写出制纳米级碳酸钙的化学方程式______________________________。
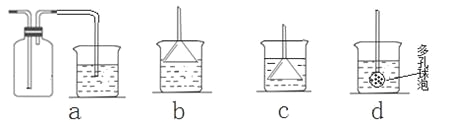
(7)若实验过程中有氨气逸出,应选用下列_____________装置回收(填代号)。
Ⅱ.经分析在上述氯化铵样品中含有杂质碳酸氢钠。为了测定氯化铵的质量分数,该学生实验小组又设计了如下实验流程:
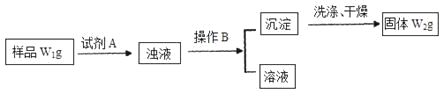
试回答:
(1)所加试剂A的化学式为______________________________________;
(2)B操作方法是_______________________________________________;
(3)样品中氯化铵的质量分数为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )
2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )

A. 维持温度、容积不变,t1时充入SO3(g)
B. 维持压强不变,t1时升高反应体系温度
C. 维持温度、容积不变,t1时充入一定量Ar
D. 维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com