
【题目】用废铅膏(含PbO2、PbSO4,少量Sn、Cu、Sb、Al的氧化物)制取超细PbO的工艺流程如图:
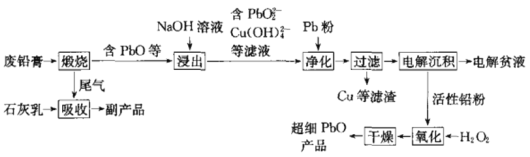
回答下列问题:
(1)“锻烧”的目的是______________________;尾气吸收得到的副产品为__________。
(2)“浸出”时,为提高铅的浸出率,可采取的措施是____________(列举两条);其中Al2O3被浸出的离子方程式为__________________。
(3)“净化”时,其中铜被除去的离子方程式为_________________________。
(4)“电解沉积”时,阴极的电极反应式为____________;“电解贫液”可返回工序中循环使用。
(5)“氧化”的化学方程式为______________________________。
【答案】使PbO2和PbSO4转化为PbO CaSO4 适当增大NaOH溶液的浓度、适当提高温度 Al2O3+2OH-=2AlO2-+H2O Pb+Cu(OH)42-=Cu+PbO22-+2H2O PbO22-+2e-+2H2O=Pb+4OH- Pb+H2O2=PbO+H2O
【解析】
废铅膏(含PbO2、PbSO4,少量Sn、Cu、Sb、Al的氧化物)煅烧,使其中的主要成分PbO2和PbSO4转化为PbO,然后用NaOH溶液浸出,浸出液中含有PbO22-和Cu(OH)42-,加入Pb粉除去铜,电解滤液,在阴极得电子生成Pb,Pb再被H2O2氧化最终得到超细PbO。
(1)“锻烧”时,PbO2分解为PbO和O2,PbSO4分解产生PbO、SO2和氧气,尾气中的SO2被石灰乳吸收生成CaSO3,被氧气氧化为CaSO4。所以煅烧的目的是使PbO2和PbSO4转化为PbO,尾气吸收得到的副产品为CaSO4。
(2)“浸出”时,为提高铅的浸出率,可采取适当增大NaOH溶液的浓度、适当提高温度等措施; “浸出”时,Al2O3可以和氢氧化钠溶液反应,离子方程式为Al2O3+2OH-=2AlO2-+H2O 。
(3)“净化”时,其中铜被Pb粉还原生成铜单质,离子方程式为Pb+Cu(OH)42-=Cu+PbO22-+2H2O。
(4)“电解沉积”时,在阴极,PbO22-得电子被还原为Pb,电极反应式为PbO22-+2e-+2H2O=Pb+4OH-。
(5)活性铅粉被H2O2氧化成PbO,H2O2被还原为H2O,化学方程式为Pb+H2O2=PbO+H2O。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】如图为元素周期表的一部分,已知A、B、C、D、E5个原子共有85个电子,E原子核外有4个电子层,则B元素是( )
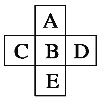
A.PB.MgC.ClD.Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸生产中,500 ℃时,NH3和O2可能发生如下反应:
①4NH3 (g)+5O2(g) ![]() 4NO(g)+6H2O(g)ΔH=-9072 kJ·mol-1 K=1.1×1026
4NO(g)+6H2O(g)ΔH=-9072 kJ·mol-1 K=1.1×1026
②4NH3(g)+4O2(g) ![]() 2N2O(g)+6H2O(g)ΔH=-1104.9 kJ·mol-1 K=4.4×1028
2N2O(g)+6H2O(g)ΔH=-1104.9 kJ·mol-1 K=4.4×1028
③4NH3(g)+3O2(g) ![]() 2N2 (g)+6H2O(g)ΔH=-1269.02 kJ·mol-1 K=7.1×1034
2N2 (g)+6H2O(g)ΔH=-1269.02 kJ·mol-1 K=7.1×1034
其中,②、③是副反应。若要减少副反应,提高单位时间内NO的产率,最合理的措施是( )
A.增大O2浓度
B.使用合适的催化剂
C.减小压强
D.降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程不能达到实验目的的是( )
实验目的 | 实验过程 | |
A | 探究维生素C的还原性 | 向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
B | 配制100mL1.0mol/L CuSO4溶液 | 将25.0gCuSO4·5H2O配成100mL溶液 |
C | 验证X溶液中是否含有Fe2+ | 向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,观察溶液颜色变化 |
D | 除去固体KNO3中少量的NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤、洗涤、干燥 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是![]()
A.在![]() 溶液中投入足量的Zn粉:
溶液中投入足量的Zn粉:![]()
B.![]() 溶液与
溶液与![]() 溶液混合后呈中性:
溶液混合后呈中性:![]()
C.磁性氧化铁![]() 溶于氢碘酸:
溶于氢碘酸:![]()
D.![]() 溶液中通入少量
溶液中通入少量![]() :
:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、 C、D是原子序数依次增大的五种短周期主族元素。B、C、E最外层电子数之和为11;A 原子核外最外层电子数是次外层的2倍;C是同周期中原子半径最大的元素;工业上一般通过电解氧化物的方法制备D的单质;E单质是制备太阳能电池的重要材料。下列说法正确的是( )
A. 简单离子半径:B>C
B. 最高价氧化物对应水化物的酸性: A<E
C. 工业上不用电解氯化物的方法制备单质D是由于其氯化物的熔点高
D. 相同质量的C和D单质分别与足量稀盐酸反应,前者生成的氢气多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图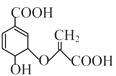 。下列关于分枝酸的叙述正确的是( )
。下列关于分枝酸的叙述正确的是( )
A.分子中含有3种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼与![]() 是常用的火箭推进剂,二者发生如下化学反应:
是常用的火箭推进剂,二者发生如下化学反应:
![]()
![]()
(1)火箭残骸中常现红棕色气体,原因为:![]()
![]()
当温度升高时,气体颜色变深,则反应![]() 为____
为____![]() 填“吸热”或“放热”
填“吸热”或“放热”![]() 反应。
反应。
(2)在一个体积为1L的恒压密闭容器中充入![]() ,一段时间后达化学平衡状态,反应的化学平衡常数表达式
,一段时间后达化学平衡状态,反应的化学平衡常数表达式![]() _________;反应3s后
_________;反应3s后![]() 的物质的量为
的物质的量为![]() ,则
,则![]() 内的平均反应速率
内的平均反应速率![]() ______
______
(3)在![]() 的平衡体系中,回答下列问题:
的平衡体系中,回答下列问题: ![]() 填“正向”、“逆向”、“不”
填“正向”、“逆向”、“不”![]()
①在溶液中加入少量的KSCN固体,平衡____移动。
②在溶液中加入少量的NaOH固体,平衡_____移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com