
【题目】常温下,已知H2A的电离平衡常数为: K1=1.3×10-7 K2=7.1×10-15现有常温下的0.1mol/L NaHA溶液。
(1)请写出H2A的电离方程式______
(2)已知NaHA溶液pH>7,请解释原因_________
(3)请写出NaHA溶液中的电荷守恒式__________
(4)NaHA溶液中粒子之间的关系式中正确的是________
A.c(A2-)+c(HA-)=0.1mol/L B.c(H+)=c(OH-)+c(A2-)
C.c(HA-)>c(OH-)>c(A2-) D.c(A2-)>c(H2A)
(5)如果H2A为H2S,则向NaHS溶液中滴加硫酸铝溶液,发生反应的离子方程式________
【答案】 )H2A![]() H++HA- HA-
H++HA- HA-![]() H++A2- HA-既能电离又能水解,由于水解大于电离,所以溶液呈碱性 [Na+]+[H-]=[OH-]+[HA-]+2[A2-] C Al3++3HS-+3H2O=Al(OH)3↓+3H2S↑
H++A2- HA-既能电离又能水解,由于水解大于电离,所以溶液呈碱性 [Na+]+[H-]=[OH-]+[HA-]+2[A2-] C Al3++3HS-+3H2O=Al(OH)3↓+3H2S↑
【解析】(1)H2A是二元弱酸,则H2A的电离方程式为H2A![]() H++HA-、HA-
H++HA-、HA-![]() H++A2-;(2)HA-既能电离又能水解,由于水解大于电离,所以溶液呈碱性;(3)NaHA溶液中的电荷守恒式为[Na+]+[H-]=[OH-]+[HA-]+2[A2-];(4)A.根据物料守恒可知c(A2-)+c(HA-)+c(H2A)=0.1mol/L,A错误;B.根据质子守恒可知c(H+)=c(OH-)+c(A2-)-c(H2A),B错误;C.HA-既能电离又能水解,由于水解大于电离,所以溶液呈碱性,则c(HA-)>c(OH-)>c(A2-),C正确;D.HA-既能电离又能水解,由于水解大于电离,所以溶液呈碱性,则c(A2-)<c(H2A),D错误,答案选C;(5)铝离子和HS-水解相互促进,则方程式为Al3++3HS-+3H2O=Al(OH)3↓+3H2S↑。
H++A2-;(2)HA-既能电离又能水解,由于水解大于电离,所以溶液呈碱性;(3)NaHA溶液中的电荷守恒式为[Na+]+[H-]=[OH-]+[HA-]+2[A2-];(4)A.根据物料守恒可知c(A2-)+c(HA-)+c(H2A)=0.1mol/L,A错误;B.根据质子守恒可知c(H+)=c(OH-)+c(A2-)-c(H2A),B错误;C.HA-既能电离又能水解,由于水解大于电离,所以溶液呈碱性,则c(HA-)>c(OH-)>c(A2-),C正确;D.HA-既能电离又能水解,由于水解大于电离,所以溶液呈碱性,则c(A2-)<c(H2A),D错误,答案选C;(5)铝离子和HS-水解相互促进,则方程式为Al3++3HS-+3H2O=Al(OH)3↓+3H2S↑。


科目:高中化学 来源: 题型:
【题目】关于1mol/L K2SO4溶液的下列说法正确的是( )
A.溶液中含有1mol K2SO4
B.1molK2SO4溶于1L水中
C.溶液中c(K+ )=2mol/L
D.1L 溶液中含2molK+ , 4mol O2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物柴油是一种用植物油、动物油或废弃油脂等为原料加工而成的清洁燃料,主要成分为高级脂肪酸甲酯。一种用菜籽油等为原料制备生物柴油的实验步骤如下:
①向右图所示的三口烧瓶中加入3.2 g CH3OH、0.2 g NaOH,溶解后向其中加入20 g(0.021~0.023 mol)菜籽油及60 mL正己烷。


②加热至60~65 ℃,搅拌2.5~3 h,静置。上层为生物柴油、正己烷及甲醇,下层主要为甘油。
③分液、水洗。
④蒸馏,保持120℃时至无液体流出,剩余物为生物柴油。
(1)步骤①中控制n(CH3OH)/n(油脂)>3的目的是________;正己烷的作用是________。
(2)步骤②适宜的加热方式是________;菜籽油的成分之一油酸甘油酯(结构简式如右图)与甲醇反应的化学方程式为________________________________________________。
(3)步骤③用分液漏斗分离时,获取上层液体的方法是________;用水洗涤上层液体时,说明已洗涤干净的依据是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门实验科学,化学反应过程中的能量变化和速率变化是中学化学研究的重要内容
Ⅰ.利用如图所示装置测定中和热
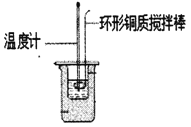
(1)图中明显有一处错误,请指出___________
(2)________(填“能”或“不能”)用Ba(OH)2 溶液和硫酸代替氢氧化钠溶液和盐酸进行中和热测定
Ⅱ.探究硫酸铜的量对氢气生成速率的影响。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积气体所需的时间。
实验 混合溶液 | A | B | C | D | E | F |
4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
(1) 请完成此实验设计,其中: V8=_________
(2) 当CuSO4溶液少量时,反应速率明显加快,原因_______
(3) 当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. C3H6和C4H8化学性质一定相似
B. 甲烷的二氯代物(CH2Cl2)有2种同分异构体
C. 用碳酸钠溶液可鉴别乙酸、苯和乙醇三种无色液体
D. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3可用于生产硝酸和尿素。
(1)生产硝酸:
① NH3催化氧化是工业制硝酸的第一步反应,其化学方程式是_____。
② 除此之外,还可能发生以下副反应:
4NH3 (g)+ 4O2 (g) === 2N2O (g) +6H2O (g) ΔH=-1105 kJ/mol
4NH3 (g) + 3O2 (g) === 2N2 (g) +6H2 O(g) ΔH=-1269 kJ/mol
两个副反应在理论上趋势均很大,但实际生产中影响并不大,原因是_____。
(2)生产尿素:
① 尿素的合成分两步进行:
a.2NH3 (g)+CO2(g) ![]() NH2COONH4(l) ΔH=-117 kJ/mol
NH2COONH4(l) ΔH=-117 kJ/mol
b.NH2COONH4(l) ![]() CO(NH2)2(l)+H2O(l) ΔH=+15 kJ/mol
CO(NH2)2(l)+H2O(l) ΔH=+15 kJ/mol

写出总反应的热化学方程式:______。
② 右图为n(NH3):n(CO2) = 4 : 1时,温度对CO2的转化率的影响。解释温度升高CO2的平衡转化率增大的原因:______。
③ 测定尿素样品含氮量的方法如下:取a g尿素样品,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L1 NaOH溶液恰好中和,则尿素样品中氮元素的质量分数是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将2mol气体A与1mol气体B充入一个体积不变的容器内,发生反应:2A+B![]() C+3D+4E,达到平衡后气体A的浓度减少一半,发现少量液滴生成,在相同的温度下测得反应前后压强分别为6.06×106Pa和8.08×106Pa,又测得反应共放出热量QkJ,下列说法正确的是( )
C+3D+4E,达到平衡后气体A的浓度减少一半,发现少量液滴生成,在相同的温度下测得反应前后压强分别为6.06×106Pa和8.08×106Pa,又测得反应共放出热量QkJ,下列说法正确的是( )
A. 上述反应达到平衡后,其他的条件不变的情况下,升高温度,压强一定增大
B. 在上述平衡体系中再加入1molA和0.5molB,平衡正向移动,A的转化率增大
C. 该反应的热化学方程式为2A(g)+B(g)![]() C(g)+3D(l)+4E(g)△H=﹣QkJ/mol
C(g)+3D(l)+4E(g)△H=﹣QkJ/mol
D. 该反应在任何温度下都可自发进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com