
【题目】氧化还原反应与基本反应类型的关系如图所示,则下列化学反应属于氧化还原反应但不包含在1,2,4范围内的是

A.Cl2+2KI=I2 +2KCl
B.NH4HCO3=NH3↑+CO2↑+H2O↓
C.2FeCl2+Cl2=2FeCl3
D.3NO2+H2O=2HNO3 +NO
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 标准状况下,18g水的体积约为 22.4L
B. 25℃,1.01×105Pa,64gSO2中含有的氧原子数为3NA
C. NA个一氧化碳分子和 0.5mol 甲烷的质量比为 7∶4
D. 同温同压下,相同体积的气体单质含有的原子数目不一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pOH=-lgc(OH-)。室温下,将稀盐酸滴加到某一元碱(BOH)溶液中,测得混合溶液的pOH与离子浓度的变化关系如图所示。下列叙述错误的是

A. BOH属于弱碱
B. BOH的电离常数K=1×10-4.8
C. P点所示的溶液中:c(Cl-)>c(B+)
D. N点所示的溶液中:c(H+)=c(Cl-)+c(OH-)-c(BOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与阿伏加德罗常数的值(NA)有关的说法正确的是
A. 标准状况下,44.8LHF中含有氢原子的数目为2NA
B. 8.0gCu2S和 CuO的混合物中含有铜原子数为0.1NA
C. 0.2mol·L-1的碳酸钠溶液中CO32-的数目小于0.2NA
D. 1LpH=3的盐酸与1LpH=3的CH3COOH溶液中,水电离出的H+数目均为10-3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数。X与Y位于不同周期,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,元素Z的单质是目前使用量最大的主族金属元素单质。下列说法中正确的是
A. 离子化合物YX4W溶于水后,得到的溶液呈碱性
B. 化合物YW3为共价化合物,电子式为![]()
C. Y、Z形成的一种化合物强度高,热膨胀系数小,是良好的耐热冲击材料
D. 工业上常用电解Z与W形成的化合物的方法制取单质Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 己知化合物N是一种对氨基苯甲酸酯类物质,可作局部麻醉药。合成N的一种路线如下图:

已知以下信息:
①核磁共振氢谱显示B只有一种化学环境的氢,H苯环上有两种化学环境的氢;
②
③E为芳香烃,其相对分子质量为92;
④![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)A的化学名称是_______________,检验B中官能团的试剂是____________,N中官能团的名称是_________________。
(2)由E生成F的化学方程式为____________________________。
(3)由F生成G的反应类型为______________,H在一定条件下可以发生聚合反应,写出该聚合反应的化学方程式:_______________________。
(4)D的同分异构体中不能与金属钠反应生成氢气的共有________种(不考虑立体异构)。
(5)参照上述合成路线,以乙烯、干醚和环氧乙烷为原料(无机试剂任选)制备1,6-已二醛,设计合成路线:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是
A.3g3He含的中子数为2NA
B.28g乙烯(C2H4)和环丁烷(C4H8)的混合气体所含碳原子数为2NA
C.标准状况下22.4LCl2与NaOH溶液完全反应,转移的电子数为2NA
D.1L0.4mol/L盐酸与0.1molMnO2共热后,生成Cl2的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的________________。
(2)氯化铝溶液具有净水的作用,原因是(用离子方程式表示):_______________。
(3)已知CO (g) + H2O (g) ![]() CO2 (g) + H2 (g),在800℃时,该反应的化学平衡常数K=1.0,某时刻在一密闭容器中含1.0molCO、1.2mol H2O、0.75molCO2、2mol H2 ,则上述条件下此反应v正________v逆(填“>”“<”或“=”)。
CO2 (g) + H2 (g),在800℃时,该反应的化学平衡常数K=1.0,某时刻在一密闭容器中含1.0molCO、1.2mol H2O、0.75molCO2、2mol H2 ,则上述条件下此反应v正________v逆(填“>”“<”或“=”)。
(4)将25℃下pH=12的NaOH溶液a L与pH=1的HCl溶液b L混合。若所得混合液为中性,则a:b=_____________________。
(5)写出0.1mol/LNaOH溶液1L与标准状况下1.12LCO2完全反应后所得的溶液中各种离子浓度由大到小的顺序为____________________________。
(6)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为________________。用该原电池做电源,常温下,用惰性电极电解200 mL饱和食盐水(足量),消耗标准状况下的CO 的体积为224 mL,则溶液的pH = ___________ 。(不考虑溶液体积的变化)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏伽德罗常数的值,则下列说法正确的是
A. 标准状况下,2.24L N2和O2的混合气体中分子数为0.1NA
B. 32g S8(分子结构: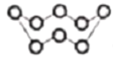 )中的共价键数目为8NA
)中的共价键数目为8NA
C. 3mol SO2和1mol O2于密闭容器中催化反应后分子总数为3NA
D. pH=1的H3BO3溶液中,含有H+的总数为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com