
【题目】下列关于新能源的说法正确的是( )
A.沼气与瓦斯都是新能源,但其主要成分不同
B.目前科学家在太阳能、氢能、风能、地热能等领域已取得了一定的进展
C.氢能的热值低于汽油
D.风能的来源与太阳能无关
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】海水化学资源开发利用的部分过程如图所示,下列说法正确的是
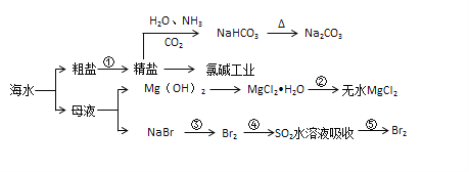
A. 从海水中得到粗盐主要是通过蒸发操作实现的
B. 用澄清的石灰水可鉴别NaHCO3和Na2CO3
C. 在步骤②中可通过直接加热的方法实现
D. 在步骤④中,SO2水溶液吸收Br2后,溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对危险化学品要在包装上印上警示性标志,下列化学品的名称与警示性标志名称对应正确的是
A. 烧碱——爆炸品 B. 浓硫酸——剧毒品
C. 汽油——腐蚀品 D. 酒精——易燃品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组研究溶液中AgNO3和Na2S的反应。
实验 | 试剂 | 现象 | |
| 试管 | 滴管 | |
(pH = 4) |
(pH = 9) | 出现黑色沉淀 | |
(1)用离子方程式解释Na2S溶液pH > 7的原因:________。
(2)实验小组同学认为黑色沉淀中可能含有Ag2O、Ag2S或Ag,设计实验验证。
已知:i.浓硝酸能将Ag2S转化为![]() 和
和![]() ;
;
ii.Ag2O能溶解在浓氨水中形成银氨溶液,而Ag2S和Ag均不能。
① 设计并实施如下实验,证实沉淀中含有Ag2S。

试剂1和试剂2分别是_________、_________。
现象1和现象2分别是_________、_________。
② 设计并实施如下实验,证实沉淀中不含有Ag2O,将实验操作和现象补充完整。
实验操作 | 实验现象 | |
步骤i | 取少量银氨溶液,向其中滴加盐酸 | 出现白色沉淀 |
步骤ii | 取少量洗涤后的黑色沉淀,____________ | ____________ |
③ 经检验,沉淀不含有Ag。

(3)实验小组同学认为AgNO3溶液具有氧化性,在一定条件下能够氧化Na2S,设计实验进行研究(实验装置如右图所示),测得电压为a(![]() )。
)。
对AgNO3溶液中氧化![]() 的物质进行推测:
的物质进行推测:
假设1: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() ;
;
假设2: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() 。
。
利用右图装置继续研究(已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
① 将![]() 的AgNO3溶液替换为_______溶液,记录电压为b(
的AgNO3溶液替换为_______溶液,记录电压为b(![]() )。
)。
② 上述实验证实了氧化![]() 的物质中一定包含
的物质中一定包含![]() ,其证据是______。
,其证据是______。
实验结论:AgNO3溶液与Na2S溶液的反应类型与反应条件有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金(质量为m g)投入到50mL1mol/L的HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L的NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中正确的是
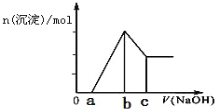
A. 假设a=25,整个反应过程中,主要发生了6个离子反应
B. c值越大,合金中Mg的含量越高
C. b值越大,合金中Al的含量越高
D. 根据图象判断,镁铝合金与50mL1mol/L的HCl溶液恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关镁及其化合物的离子方程式书写正确的是( )
A.MgCO3与盐酸反应:CO32-+2H+=CO2↑+H2O
B.Mg(OH)2与H2SO4反应:Mg2++2OH-+2H++SO42-=MgSO4↓+2H2O
C.镁与醋酸反应:Mg+2H+=Mg2++H2↑
D.氯化镁溶液与AgNO3溶液反应:Ag++Cl-=AgCl↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镉(Cd)浸在氯化钴(CoCl2)溶液中,发生反应的离子方程式为Co2+(aq)+Cd(s)===Co(s)+Cd2+(aq)(aq表示溶液),如将该反应设计为如图的原电池,则下列说法一定错误的是( )
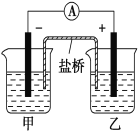
A. Cd作负极,Co作正极
B. 原电池工作时,电子从负极沿导线流向正极
C. 甲池中盛放的是CdCl2溶液,乙池中盛放的是CoCl2溶液
D. 盐桥中装有含氯化钾的琼脂,其作用是传递电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:
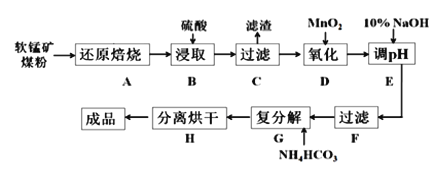
已知:还原焙烧主反应为:2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
根据要求回答下列问题:
(1)步骤B中若采用质量分数为35%的硫酸(密度ρ=1.26 g/cm3),则其物质的量浓度为____。
(2)步骤C中得到的滤渣主要成分是______________________________,步骤D中还原剂与氧化剂的物质的量之比为_____________________________。
(3)步骤E中调节pH的范围为______________________________。
(4)步骤G的离子方程式为_________________________________________,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6 mol/L,则Ksp(MnCO3)=___________。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:____Mn2+ +____ S2O82- + _____H2O = __________________________________,
①请完成上述离子方程式; _____________
②请描述Mn2+未完全反应时出现的现象__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是
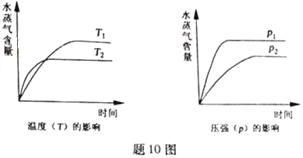
A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com