
【题目】短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素。
B | C | D | ||
A | E |
请用化学用语回答下列问题:
(1)A、D、E元素简单离子半径由大到小的顺序为 > > (填粒子符号)_____
(2)F与D同主族且相邻二者气态氢化物稳定性的大小关系为 > (填粒子符号)_________
(3)用高能射线照射含有10电子的D元素氢化物分子时,一个分子能释放出一个电子,同时产生一种
具有较强氧化性的阳离子,试写出该阳离子的电子式:______________。该阳离子中存在的化学键有_________。
(4)由C、E两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子中C、E两种原子最外层均达到8个电子的稳定结构。甲遇水蒸气可形成一种常见的漂白性物质。写出甲遇水蒸气的化学方程式__________。
【答案】 Cl-O2-Al3+ H2O H2S ![]() 共价键(或极性共价键) NCl3+3H2O=NH3+3HClO
共价键(或极性共价键) NCl3+3H2O=NH3+3HClO
【解析】分析:短周期主族元素中,A为地壳中含量最高的金属元素,则A为Al元素,由元素在周期表中的相对位置,可以知道B为碳元素、C为N元素、D为O元素、E为Cl。
(1)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大;
(2)F与D同主族且相邻,则F为S元素,同主族自上而下非金属性减弱,氢化物稳定性与元素非金属性一致;
(3)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+;
(4)由N、Cl两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里N、Cl两种原子最外层均达到8个电子的稳定结构,则N、Cl个数比应为1:3,甲为NCl3。
详解: 短周期主族元素中,A为地壳中含量最高的金属元素,则A为Al元素,由元素在周期表中的相对位置,可以知道B为碳元素、C为N元素、D为O元素、E为Cl。
(1)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大;故离子半径:Cl->O2->Al3+;
因此,本题正确答案是: Cl-;O2-;Al3+;
(2)F与D同主族且相邻,则F为S元素,同主族自上而下非金属性减弱,氢化物稳定性与元素非金属性一致,故氢化物稳定性:H2O>H2S;
因此,本题正确答案是: H2O;H2S;
(3)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+;电子式为:![]() ,含有的化学键为共价键,
,含有的化学键为共价键,
因此,本题正确答案是:![]() ;共价键;
;共价键;
(4)由N、Cl两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里N、Cl两种原子最外层均达到8个电子的稳定结构,则N、Cl个数比应为1:3,甲为NCl3。甲遇水蒸气可形成一种常见的漂白性物质应为次氯酸,所以在甲中氯显+1价, 甲遇水蒸气的化学方程式:NCl3+3H2O=NH3+3HClO,
因此,本题正确答案是:NCl3+3H2O=NH3+3HClO。


科目:高中化学 来源: 题型:
【题目】可逆反应:2A(g)+2B(g)C(g)+3D(g) 在不同情况下测得下列4种反应速率,其中反应最快的是( )
A.v(A)=0.45mol/(Ls)
B.v(B)=0.6mol/(Ls)
C.v(C)=0.5mol/(Lmin)
D.v(D)=0.4mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是( ) 
A.图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol/L KMnO4酸性溶液与过量的0.1 mol/L H2C2O4溶液混合时,n(Mn2+)随时间的变化
D.图④中a、b曲线分别表示反应:CH2═CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的总能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是;(填序号),配制上述溶液还需用到的玻璃仪器是(填仪器名称). 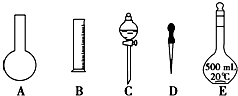
(2)配制NaOH时,在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度0.1mol/L(填“大于”、“等于”或“小于”).
(3)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL(计算结果保留一位小数).在实验中其他操作均正确,若用量筒量取浓硫酸时仰视刻度线,则所得配得溶液浓度0.5mol/L(填“大于”、“等于”或“小于”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A. 单位时间内生成nmolA2同时生成nmolAB
B. 单位时间内生成2nmolAB的同时生成nmolB2
C. 容器内的总物质的量不随时间变化
D. 单位时间内断开1molA-A键的同时生成2molA-B键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从海带灰中提取碘的操作过程中仪器选用不正确的是
A. 称取3 g左右的干海带——托盘天平
B. 灼烧干海带至完全变成灰烬——蒸发皿或坩埚
C. 过滤煮沸后的海带灰和水的混合物——漏斗
D. 用四氯化碳从氧化后的海带灰浸取液中提取碘——蒸馏烧瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
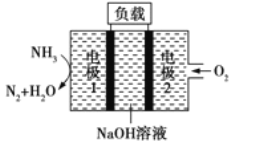
【题目】(1)锌电池有望代替铅蓄电池,它的构成材料是锌、空气某种电解质溶液,发生的总反应式是:2Zn+O2=2ZnO。则该电池的负极材料是(写名称)____________;当导线中有1mol电子通过时,理论上消耗的O2在标准状况下的体积是__________。
(2)瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如下所示,该燃料电池工作时,外电路中电子的流动方向是从电极________到电极________(填“1”或“2”),电池的总反应为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一实例能证明微量元素是生命活动所必需的
A. Mg是叶绿素的组成部分
B. 油菜缺少B时只开花不结果
C. 哺乳动物血液中Ca2+含量太低,会抽搐
D. 缺P会影响ATP的合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是
A. 灼热的炭与CO2反应 B. 氧化铁与铝反应
C. 钠与乙醇反应 D. Ba(OH)2·8H2O与NH4C1反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com