
【题目】NH5属于离子晶体。与水反应的化学方程式为:NH5+H2O→NH3H2O+H2↑,它也能跟乙醇发生类似的反应,并都产生氢气。有关NH5叙述正确的是( )
A.与乙醇反应时,NH5被氧化
B.NH5中N元素的化合价为+5价
C.1molNH5中含有5molN-H键
D.1molNH5与H2O完全反应,转移电子2mol
科目:高中化学 来源: 题型:
【题目】已知A~G是几种烃分子的球棍模型,据此回答下列问题:
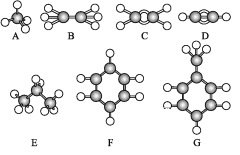
(1)上述七种烃中:
①常温下含碳量最高的气态烃是____(填结构简式)。
②能够发生加成反应的烃有____种。
③与A互为同系物的是____(填对应字母)。
④一卤代物种类最多的是____(填对应字母)。
(2)写出C发生加聚反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置探究铁在海水中的电化学防护,下列说法不正确的是

A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁电极的反应:Fe2e =Fe2+
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁电极的反应:2H++2e=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如下图所示。
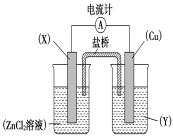
请回答下列问题:
(1)电极X的材料是____________;电解质溶液Y是__________________。
(2)铜电极为电池的________极,发生的电极反应为_______________________ X极上发生的电极反应为______________。
(3)外电路中的电子是从________极流向__________极(填名称)。
(4)盐桥中的Cl-向________极移动,如将盐桥撤掉,电流计的指针将________偏转。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及部分重要化合物的相互转化如图所示。
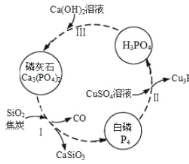
(1)不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为______。
(2)步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有______。
磷灰石是生产磷肥的原料,它的组成可以看作是Ca3(PO4)2、CaF2、CaSO4、CaCO3、SiO2的混合物,部分元素的分析结果如下(各元素均以氧化物形式表示):
成分 | CaO | P2O5 | SO3 | CO2 |
质量分数(%) | 47.30 | 28.40 | 3.50 | 6.10 |
(3)磷灰石中,碳元素的质量分数为______%(保留两位小数)。
(4)取100g磷灰石粉末,加入足量的浓硫酸,并加热,钙元素全部以CaSO4的形式存在,可以得到CaSO4______g(保留两位小数)。
(5)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1mol/L)与其反应,结果Ca、S、P元素全部以CaSO4和Ca(H2PO4)2的形式存在,求m的值______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,NH4+的水解平衡常数为Kb=5.556×10 -10。该温度下,用0.100 mol·L-1的氨水滴定10.00ml 0.050 mol·L-1的二元酸H2A的溶液,滴定过程中加入氨水的体积(V 与溶液中lg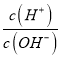 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
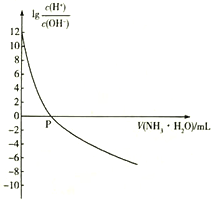
A. H2A的电离方程式为H2A![]() H++A2-
H++A2-
B. 25℃时,Kb(NH3·H2O)=1.8×10-5
C. P点时加入氨水的体积为10 mL
D. 向H2A溶液中滴加氨水的过程中,水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取冰晶石(Na3AlF6)的化学方程式如下:![]()
完成下列填空:
(1)反应中四种元素对应的简单离子核外电子排布相同,请按离子半径从大到小的顺序排列这四种离子____,其中原子序数最大的元素原子核外有___种能量不同的电子,其最外层电子的电子云有____种不同的伸展方向。
(2)反应中有两种元素在元素周期表中位置相邻,能比较它们的金属性或非金属性强弱的事实是____(选填编号)。
a. 气态氢化物的稳定性 b. 最高价氧化物对应水化物的酸性
c. 单质与氢气反应的难易 d. 单质与同浓度酸发生反应的快慢
反应中两种金属元素,它们的最高价氧化物对应的水化物之间发生反应的离子方程式为_______。
(3)冰晶石在工业上可做电解氧化铝的助溶剂,此反应中若有0.6mol电子转移,则在____极可得金属铝的质量为_____克。
(4)工业上不采用电解氯化铝的方法而是采用电解氧化铝的方法获得铝单质的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两个电解池均以Pt为电极,且互相串联,甲池盛有AgNO3溶液,乙池中盛有一定量的某盐溶液,通电一段时间后,测得甲池中某电极质量增加2.16 g,乙池中某电极上析出0.24 g金属,则乙池中溶质可能是( )
A.KNO3B.MgSO4C.CuSO4D.Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组探究FeSO4的化学性质和用途。回答下列问题:
(一) 探究FeSO4溶液的酸碱性:
(1)取少量FeSO4固体,利用石蕊试液测试FeSO4溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和_____________。
A.玻璃棒 B.试管 C.天平 D.量筒
(二)利用下图装置探究FeSO4的稳定性
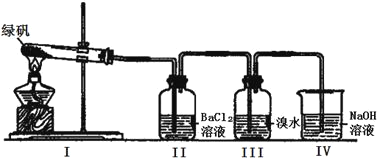
(2)II中有白色沉淀生成,小组成员结合理论分析,认为下列分解产物不可能的是_____________。
A.Fe2O3、SO3、H2O
B.Fe2O3、SO2、SO3、H2O
C.FeO、Fe2O3、SO2、SO3、H2O
(3)III中溴水是用来检验是否有SO2气体生成,若有SO2生成,溴水将褪色。实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是_______。
(4)NaOH的作用是吸收SO2气体,请写出最大量吸收SO2气体的反应化学方程式:_________。
(三)探究FeSO4中Fe2+还原性:
(5)证明FeSO4有较强的还原性,完成下表。
实验步骤 | 实验预期现象及结论 |
步骤一:取少量的FeSO4固体于试管中,加入一定量水溶解。 |
_________________________ |
步骤二:______________ |
(四)硫酸亚铁用途探究
(6)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com