
【题目】(一)室温下,在25 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,曲线如下图所示,回答下列问题:

(1)写出CH3COOH的电离方程式__________________________。
(2)下列说法不正确的是___________________。
A. 0.1 mol/L CH3COOH溶液中, CH3COOH电离度约为1%
B. B点满足: c(CH3COO-)-c(CH3COOH)=2c(OH-)-2c(H+)
C. C点时的离子浓度关系为:c(CH3COO-)= c(Na+)> c(H+)= c(OH-)
D. D点时的离子浓度关系为: c(Na+)> c(CH3COO-)> c(OH-)> c(H+)
(3)室温下,试计算CH3COOH电离平衡常数为____________(用含b的表达式表示)。
(二)实验室为测定食醋中CH3COOH的浓度,取25mL食醋置于250mL容量瓶中,加水稀释至刻度并摇匀。用酸式滴定管量取25.00mL稀释后的醋酸溶液放入锥形瓶中,加指示剂,然后用0.1000 mol·L-1NaOH标准溶液进行滴定。
(4)指示剂应为________。
A.甲基橙 B.甲基红 C.酚酞 D.石蕊
(5)滴定终点的判断方法为____________________________________________________。
(6)为提高测定的准确度,重复上述实验三次,0.1000 mol·L-1NaOH标准溶液滴定前后的读数如下表所示,则该食醋中CH3COOH的浓度为_________mol·L-1。
实验次数 | 稀释后的醋酸溶液体积/ mL | NaOH滴定前读数/ mL | NaOH滴定后读数/ mL |
第1次 | 25.00 | 0.10 | 24.00 |
第2次 | 25.00 | 0.50 | 22.50 |
第3次 | 25.00 | 0.20 | 24.30 |
(7)用0.1000 mol·L-1NaOH标准溶液进行滴定,下列操作会导致测定结果偏高的是_______。
A.碱式滴定管内滴定后产生气泡
B.读取标准液读数时,滴定前俯视,滴定到终点后仰视
C.配制0.1000 mol·L-1NaOH溶液时,固体NaOH中含有结晶水
D.碱式滴定管未润洗就装入标准液进行滴定
【答案】CH3COOH![]() CH3COO - +H+ BD 10-7b/(25-b) C 当滴入最后一滴NaOH,溶液颜色由无色变浅红色,且半分钟内不褪色 0.9600 BCD
CH3COO - +H+ BD 10-7b/(25-b) C 当滴入最后一滴NaOH,溶液颜色由无色变浅红色,且半分钟内不褪色 0.9600 BCD
【解析】
(1)醋酸是弱酸,电离方程式为:CH3COOH![]() CH3COO - +H+。
CH3COO - +H+。
(2)根据电荷守恒和物料守恒推导。
(3)溶液的PH=7,根据电荷守恒,c(CH3COO-)= c(Na+)=b×10-4 mol·L-1,根据物料守恒,c(CH3COOH)=25×10-4- b×10-4,K= c(CH3COO-) c(H+)/ c(CH3COOH)= b×10-4×10-7/(25-b)×10-4=10-7b/(25-b)。
(4)用氢氧化钠滴定醋酸,在滴定终点得到的是醋酸钠溶液,溶液呈弱碱性,所以要选用酚酞作指示剂。
(5)滴定终点的判断方法为:当滴入最后一滴NaOH,溶液颜色由无色变浅红色,且半分钟内不褪色。
(6)第2组数据无效,根据NaOH+CH3COOH=CH3COONa+H2O可知消耗NaOH的物质的量和CH3COOH的物质的量相等来计算。
(7)根据c(待测)= c(标准)×V(标准)/ V(待测)推导。
(1)醋酸是弱酸,电离方程式为:CH3COOH![]() CH3COO - +H+ ,故答案为:CH3COOH
CH3COO - +H+ ,故答案为:CH3COOH![]() CH3COO - +H+ 。
CH3COO - +H+ 。
(2)A.由图可知,滴定前0.1 mol·L-1 CH3COOH溶液的PH值为3,电离度为(10-3/0.1)×100% ≈1%;故A正确;
B.B点得到等物质的量的CH3COOH和CH3COONa的混合溶液,根据电荷守恒得c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-),根据物料守恒得2c(Na+)= c(CH3COO-)+ c(CH3COOH),整理以上两个式子得质子守恒式c(CH3COO-)+2c(OH-)= c(CH3COOH)+ 2c(H+),故B错误;
C. C点溶液的PH=7,c(H+)= c(OH-),根据电荷守恒c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-)得c(CH3COO-)= c(Na+),c(H+)、c(OH-)小于c(CH3COO-)、 c(Na+),故C正确;
D. D点得到的是等物质的量NaOH和CH3COONa的混合溶液,因CH3COO-要水解,故离子浓度大小关系c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故D错误。
故选BD。
(3)溶液的PH=7,根据电荷守恒,c(CH3COO-)= c(Na+)=b×10-4 mol·L-1,根据物料守恒,c(CH3COOH)=25×10-4- b×10-4,K= c(CH3COO-) c(H+)/ c(CH3COOH)= b×10-4×10-7/(25-b)×10-4=10-7b/(25-b),故答案为:10-7b/(25-b)。
(4)用氢氧化钠滴定醋酸,在滴定终点得到的是醋酸钠溶液,溶液呈弱碱性,所以要选用酚酞作指示剂,故选C。
(5)滴定终点的判断方法为:当滴入最后一滴NaOH,溶液颜色由无色变浅红色,且半分钟内不褪色,故答案为:当滴入最后一滴NaOH,溶液颜色由无色变浅红色,且半分钟内不褪色。
(6)NaOH+CH3COOH=CH3COONa+H2O,第1次消耗NaOH溶液的体积是23.9 mL, 第2次消耗NaOH溶液的体积是22.0 mL,第3次消耗NaOH溶液的体积是24.1mL,第2组数据无效,两次平均值为:24.0 mL,根据反应方程式可知消耗NaOH的物质的量和CH3COOH的物质的量相等,消耗NaOH的物质的量为2.4×10-3 mol,所以CH3COOH的浓度为2.4×10-3 mol/25.00×10-3L=0.096 mol·L-1, 实验室为测定食醋中CH3COOH的浓度,取25mL食醋置于250mL容量瓶中,加水稀释至刻度并摇匀,所以该食醋中CH3COOH的浓度为0.9600mol·L-1。故答案为:0.9600。
(7)根据c(待测)= c(标准)×V(标准)/ V(待测)推导
A. 碱式滴定管内滴定后产生气泡,导致消耗标准溶液体积偏小,测定结果偏小,故A错误;
B. 读取标准液读数时,滴定前俯视,滴定到终点后仰视,导致消耗标准溶液体积偏大,测定结果偏大,故B正确;
C. 配制0.1000 mol·L-1NaOH溶液时,固体NaOH中含有结晶水,所配溶液浓度小于0.1000 mol·L-1,导致消耗标准溶液体积偏大,故测定结果偏高,故C正确;
D. 碱式滴定管未润洗就装入标准液进行滴定,造成消耗的V(标准)偏大,故测定结果偏高,故D正确。
故选BCD。


科目:高中化学 来源: 题型:
【题目】某小组利用氯酸钾与10 mol·L-1盐酸反应制氯气并进行氯气性质的探究,实验装置如图所示:

请回答:
(1)装置F的名称是____________。
(2)E中实验现象是___________。
(3)根据相关实验现象就可以证明起漂白作用的不是氯气而是次氯酸,相关现象是_________。
(4)现要配制240mL 10 mol·Lˉ1所需盐酸,请回答下列问题:
①所用的仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要的仪器是_________。
②配制好的盐酸放入试剂瓶中后,需要贴上标签,请你在图标签上填好所配溶液的信息_________。

③配制过程中有下列实验操作步骤,其正确的顺序为___________________。
④下列操作会使配制结果偏高的是__________________。
A.容量瓶洗净后未干燥直接用来配制溶液
B.反复摇匀后发现液面低于刻度线,继续加水至刻度线
C.定容时俯视读数
D.用量筒量取浓盐酸配制所需盐酸时,量筒仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和氮的相关化合物在很多领域有着广泛的应用。请回答:
I.搭载“神舟十一号”的长征-2F火箭使用的推进剂燃料由N、H两种元素组成,且原子个数N:H=1:2,其水溶液显碱性。
(1)该物质中N原子的杂化方式为________,溶于水呈碱性的原因为___________(用离子方程式表示)。
(2)氮元素的第一电离能比相邻的氧元素大,其原因为________________。
II.笑气(N2O)曾被用作麻醉剂,但过度吸食会导致身体机能紊乱。
(3)预测N2O的结构式为________________。
(4)在短周期元素组成的物质中,写出与NO2-互为等电子体的分子_________。(写两个,填分子式)
III.氮化钛为金黄色晶体,有仿金效果,越来越多地成为黄金的代替品。
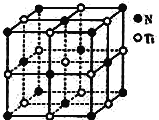
(5)Ti金属晶体的堆积模型为________,配位数为_______,基态Ti3+中未成对电子数有______个。
(6)氮化钛晶体的晶胞与NaCl晶胞相似(如图所示),该氮化钛的密度为ρg·cm-3,则该晶胞中N、Ti之间的最近距离为______nm(NA为阿伏加德罗常数的值,只列计算式)。该晶体中与氮原子距离相等且最近的钛原子围成的空间几何体为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近我国科学家在液流电池研究方面取得新进展。一种硫/碘体系(KI/K2S2)的液流电池工作原理如图所示。下列说法正确的是( )

A. 放电时电池右侧为负极,发生氧化反应
B. 放电时电池左侧的电极反应为S22-+2e-==2S2-
C. 充电时电解质溶液中K经交换膜向右侧移动
D. 充电时电池的总反应为3I-+S22-=I3-+2S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂。常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,极易溶于水,不与水反应。若温度过高,二氧化氯的水溶液可能会发生爆炸。某研究性学习小组拟用如下图所示装置制取并收集ClO2(加热和夹持装置均省略)。

(1)在圆底烧瓶中先放入一定量的KClO3和草酸H2C2O4),然后再加入足量的稀硫酸,在60~80℃之间反应生成ClO2、CO2和一种硫酸盐,该反应的化学方程式为________。
(2)装置A中使用温度计的目的是____。反应开始后,可以观察到圆底烧瓶内的现象是_____。
(3)装置B的作用是________。
(4)实验过程中装置D中的溶液里除生成Na2CO3外,还生成物质的量之比为1︰1的另外两种盐,一种为NaClO3,另一种为_______。
(5)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:量取ClO2溶液20mL,稀释成100mL试样,量取V1mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,振荡后,静置片刻;
步骤3:加入指示剂X,用 cmol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液V2mL。
已知:2ClO2+8H++10I-==5I2+2C1-+4H2O 2Na2S2O3+I2=Na2S4O6+2NaI
请回答:
①配制100mL步骤3中所需的Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需要_______。(填仪器名称)
②步骤3中滴定终点的现象为_______。
③原ClO2溶液的浓度为_______g·L-1(用含字母的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)材料是人类赖以生存的物质基础,是人类社会进步的里程碑。
①下列属于硅酸盐材料的是________(填字母,下同)。
a. 青花瓷 b. 青铜 c. 沥青
②为防止钢铁器件腐蚀,下列举措不合理的是________。
a. 表面镀锌 b. 使用不锈钢 c. 表面附着铜片
③制造玻璃和水泥的主要原料中,均用到的原料是________。
a. 石灰石 b. 纯碱 c. 黏土
(2)某品牌食品调料标签的一部分如右图。

①配料中的大量氨基酸态氮来源于黄豆中的蛋白质发生________反应得到。
②小麦粉中的主要营养物质是________。
③配料中,属于着色剂的是______;属于甜味剂的是__________;属于防腐剂的是______。
(3)绿色发展、低碳发展和循环发展是生态文明建设的基本途径。
①从源水处理成自来水,常需加入明矾、活性炭处理以及通氯气处理等,其中通氯气处理的作用是__________________________。
②目前我国空气质量检测体系包括:PM2.5、PM10、SO2、NO2、O3、CO六项指标。六项指标中对雾霾天气的形成有促进作用、雾霾天气又能进一步加剧其积聚颗粒物的是__________;引起酸雨的气体为SO2和________;煤中加入适量的石灰石可以减少燃煤产生的SO2,发生反应的化学方程式为______________________________________________。
③用二氧化碳生产化工产品,有利于二氧化碳的大量回收。CO2和H2在催化剂及高温、高压条件下可以合成乙醇,该反应的化学方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列硫燃烧时的能量变化图,判断有关热化学方程式和说法正确的是( )

A. S(s,单斜)+O2(g)===SO2(g) ΔH=+297.16 kJ·mol-1
B. S(s,正交)===S(s,单斜) ΔH=-0.33 kJ·mol-1
C. S(s,正交)+O2(g)===SO2(g) ΔH=-296.83 kJ·mol-1
D. 单斜硫的稳定性大于正交硫的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用有机原料A制备 和聚乙酸乙烯酯,其流程为:
和聚乙酸乙烯酯,其流程为:

已知:①![]() ②
②![]()
请回答下列问题:
(1)A→B的反应类型是___________,J中官能团的名称为___________。
(2)反应②的试剂和条件分别是___________,G的结构简式是___________。
(3)写出反应①的化学方程式:_________________________________。
(4)与A具有相同官能团且只有一个甲基的芳香化合物的同分异构体有多种,写出其中一种核磁共振氢谱为五组峰且能发生银镜反应的结构简式为______________________。
(5)参照下述示例合成路线,设计一条由乙二醇为起始原料制备聚乙二酸乙二醋的合成路线。示例:![]() _______________
_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中电负性最大。
(1)试推断A、B、C、D四种元素的符号:A________、B________、C________、D________。
(2)写出A元素原子的核外电子排布式:____________;写出B元素原子核外电子排布的价电子构型:__________;用电子排布图表示C原子的核外电子排布情况:_______________。
(3)比较四种元素的第一电离能和电负性的大小:第一电离能____________;电负性____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com