
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:

(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是_________________________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
ⅰ:2Fe2++PbO2+4H++SO42-=2Fe3++PbSO4+2H2O
ⅱ:……
写出ⅱ的离子方程式:______________________。
(3)PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示。过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是_________(选填序号)。
NaHPbO2(aq),其溶解度曲线如图所示。过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是_________(选填序号)。

A.减少PbO的损失,提高产品的产率
B.重复利用氢氧化钠,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
(4)PbO2在加热的过程中发生分解生成PbO和O2,其失重曲线如图所示,已知失重曲线上的a点为样品分解40%的残留固体,若a点固体组成表示为PbOx,则x=_________。

【答案】 Pb+PbO2+H2SO4=2PbSO4+H2O Pb+2Fe3++SO42-=PbSO4+2Fe2+ AB 1.6
【解析】本题考查了化学工艺流程分析,离子方程式的书写、化学实验方案的谁、物质的分离提纯等,难度中等。
(1)根据题给化学工艺流程可知,过程Ⅰ中,在亚铁离子催化下,Pb和PbO2反应生成PbSO4和水,方程式为: Pb+PbO2+H2SO4=2PbSO4+H2O。(2)规划及通过参加反应,改变反应历程,降低反应的活化能,加快反应速率,而本身的质量和化学性质前后保持不变,根据题给信息可知反应中亚铁被二氧化铅氧化为铁离子,则反应ⅱ中铁离子被铅还原为亚铁离子,离子方程式为: Pb+2Fe3++SO42-=PbSO4+2Fe2+。 (3) 过程Ⅱ中脱硫过程中发生的反应为PbO2+ 2NaOH=PbO+Na2SO4+H2O,由于氧化铅能溶解于氢氧化钠溶液,因此滤液Ⅰ中含有铅元素,滤液Ⅰ重复使用可以减少氧化铅的损失,提高产品的差率,且滤液Ⅰ中过量的氢氧化钠可以重复使用,提高原料的利用率,因此选AB。 (4) PbO2在加热的过程中发生分解生成PbO和O2,a点分解49%,假设取1mol二氧化铅,40%分解,即0.4mol分解生成0.4mol氧化铅,则产物中含有0.6mol二氧化铅和0.4mol氧化铅,则铅和氧原子个数比为(0.6+0.4):(0.6×2+0.4)=1:1.6,故答案为:1.6。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
A. AlCl3和NaOH B. H2SO4和Ba(OH)2
C. NaAlO2和H2SO4 D. Na2CO3和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“司乐平”是治疗高血压的一种临床药物,其有效成分M的结构简式如图所示。
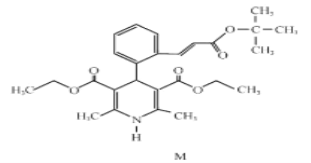
(1)下列关于M的说法正确的是______(填序号)。
a.属于芳香族化合物
b.遇FeCl3溶液显紫色
c.能使酸性高锰酸钾溶液褪色
d.1molM完全水解生成2mol醇
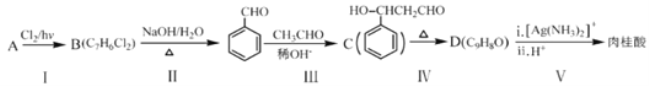
(2)肉桂酸是合成M的中间体,其一种合成路线如下:
已知: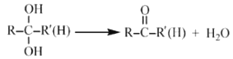
①烃A的名称为______。步骤I中B的产率往往偏低,其原因是__________。
②步骤III的反应类型是________。
③步骤Ⅳ反应的化学方程式为______________________________。
④肉桂酸的结构简式为__________________。
⑤C的同分异构体有多种,其中苯环上有一个甲基的酯类化合物有_____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 含大量Fe3+的溶液中:Na+、Mg2+、SO42-、SCN-
B. ![]() =106的溶液中:NH4+、K+、AlO2-、NO3-
=106的溶液中:NH4+、K+、AlO2-、NO3-
C. 能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42-、Cl-
D. 1.0mol·L-1的KNO3溶液中:Fe2+、H+、Cl-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液X中可能含有K+、Mg2+、Al3+、AlO、SiO、CO、SO、SO中的若干种离子。某同学对该溶液进行了如下实验:

下列判断正确的是( )
A. 气体甲一定是纯净物 B. 沉淀甲是硅酸和硅酸镁的混合物
C. K+、AlO和SiO一定存在于溶液X中 D. CO和SO一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知a、b、c、d四种短周期主族元素,在周期表中相对位置如下图所示,下列说法正确的是( )

A. a、c两元素的最高正价一定相等
B. d的原子序数不可能是b的原子序数的3倍
C. 若c元素最高价氧化物对应的水化物是强酸,则d元素的单质具有强氧化性
D. c的最高价氧化物对应的水化物可溶于d的最高价氧化物对应的水化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成VO2+。
(1)请写出金属钒与足量浓硝酸反应的离子方程式:___________________________。
(2)灼烧NH4VO3时可生成钒的氧化物V2O5,请写出该反应的化学方程式:______________________。
(3)V2O5是较强的氧化剂。它能与沸腾的浓盐酸作用产生氯气,其中钒元素被还原为蓝色的VO2+,请写出该反应的离子方程式:__________________。
(4)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出V2O5与烧碱溶液反应生成的盐的化学式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物炼铜实际上是微生物帮助我们从矿石中提取铜。这些“吃岩石的细菌”能利用空气中的氧气将不溶性的CuS转化成可溶性铜的化合物,该化合物是( )
A.碳酸铜B.硝酸铜C.硫酸铜D.氢氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A |
| 两个有机反应的反应类型都是加成反应 |
B | H2O+2SO2 +CO32-=CO2 +2HSO3- H2O+CO2 +SiO32-=H2CO3↓ +CO32- | 由这两个反应不能得出非金属性:S> C> Si |
C | 2F2+2H2O=4HF+O2 2Na2O2+2H2O=4NaOH+O2↑ | 两个反应中的H2O均被氧化 |
D | NH4++H2O H2PO4-+H2O | 两个离子方程式均为水解方程式 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com