
【题目】已知(CN)2的氧化性比Br2弱而比I2强,NaCN的水溶液呈碱性,则下列有关变化一般不能发生的是
A. CH2=CH2+(CN)2→NC-CH2-CH2-CN
B. (CN)2+2Br-→2CN-+Br2
C. (CN)2+2OH-→CN-+CNO-+H2O
D. HCN![]() H++CN-
H++CN-
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】在盛有溴水的三支试管中分别加入汽油、四氯化碳和酒精,振荡后静置,出现如图所示的现象。下列说法正确的是( )

A.①加入的是CCl4,②加入的是汽油,③加入的是酒精
B.①加入的是酒精,②加入的是CCl4,③加入的是汽油
C.①加入的是汽油,②加入的是酒精,③加入的是CCl4
D.①加入的是汽油,②加入的是CCl4,③加入的是酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol·L-1FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压数值):

(1)用KSCN溶液检验出Fe3+的现象是_______________________________________。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应: _____________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有________性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:

①NaCl溶液的浓度是________ mol·L-1。
②Ⅳ中检测Cl2的实验方法:______________________________________________。
③与Ⅱ对比,得出的结论(写出两点):_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有关物质的量浓度的配制下列说法正确的是___
A.称取2.0gNaOH固体:先在托盘各放1张滤纸,然后在右盘加2g砝码,左盘加NaOH固体
B.容量瓶上标有温度和容积使用前要检查是否漏水
C.称取16.0gCuSO4 固体在500mL容量瓶中加水溶解后定容,可配得0.20mol/L的CuSO4溶液
D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再慢慢注入浓硫酸
E.配制溶液时,俯视容量瓶刻度线造成浓度偏高
F.溶液转移定容时,溶液未冷却至室温造成浓度偏低
(2)海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(每一步所加试剂均过量):

现有下列仪器,请按要求填写以下空白:
Ⅰ.步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,图中还缺少的玻璃仪器是___。
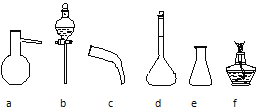
Ⅱ.如何检验步骤③操作后碘化钠滤液中的碘离子___,步骤⑤所需的操作名称是__。
Ⅲ.写出步骤④的化学反应方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实可以用勒夏特列原理解释的是( )
A. 新制的氯水在光照条件下颜色变浅
B. 使用催化剂,提高合成氨的产量
C. 高锰酸钾(KMnO4)溶液加水稀释后颜色变浅
D. H2、I2、HI平衡混合气体加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代高科技领域使用的新型陶瓷材料氮化硼(BN),用天然硼砂(Na2B4O710H2O)经过下列过程可以制得。
天然硼砂![]() 硼酸(H3BO3)
硼酸(H3BO3)![]() B2O3
B2O3![]() BN
BN
(1)天然硼砂所含的元素中属于同一周期且原子半径是(用元素符号填写)___>___,由天然硼砂中的三种元素形成的某种离子化合物的电子式为______。
(2)与硼元素性质最相似的元素的原子的最外层电子排布为_______,该原子核外充有电子的轨道共有____个。
(3)试写出天然硼砂与硫酸反应的化学方程式_______,制得的氮化硼有不同的结构,其中超硬、耐磨、耐高温的一种属于____晶体。制取氮化硼的反应必须在密闭的耐高温容器中进行:B2O3(s)+2NH3(g)![]() 2BN(s)+3H2O(g)+Q(Q<0)
2BN(s)+3H2O(g)+Q(Q<0)
(4)若反应在5L的密闭容器中进行,经2分钟反应炉内固体的质量减少60.0g,则用氨气来表示该反应在2分钟内的平均速率为_____,达到平衡后,增大反应容器体积,在平衡移动过程中,逆反应速率的变化状况为______。
(5)为提高生产效率,使反应速率加快的同时,化学平衡向多出产品的方向移动,可以采取的措施有_________,生产中对尾气的处理方法正确的是(填序号)_____。
A.直接排出参与大气循环 B.冷却分离所得气体可以循环使用
C.全部用来进行循环使用 D.冷却分离所得液体可作化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示:浅绿色的FeSO4·7H2O加热失水为FeSO4·H2O时呈白色,成FeSO4时为无色固体。FeSO4经加热可分解为FeO和SO3,经强热可分解为Fe2O3、SO3和SO2。SO3的熔点为16.8℃,沸点为44.8℃。化学兴趣小组对上述资料进行实验探究。
第一步:用绿矾制无水硫酸亚铁。
(1)把药品装在仪器(写名称)____中进行加热,已将结晶水除净的依据是(选填序号)___。
A.观察无水蒸汽产生 B.经恒重操作最后两次称量所得到的质量完全相同
C.晶体完全变为无色 D.经恒重操作最后两次质量差不超过天平感量误差
第二步:取一定量无水硫酸亚铁置于如图(部分夹持仪器略去)所示A的试管中进行加热。
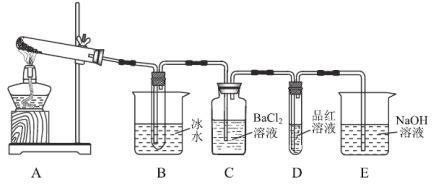
(2)实验过程中C、D、E中除有少许气泡外无其它明显现象。若将B试管中产生的少量固体溶于水,检验该溶液中的阴离子的方法是:___。实验过程中还有一处明显的现象是:________________。
第三步:将第二步实验的装置中A、B部分改为如图所示的![]() 、
、![]() ,C,D,E不变(C,E中都装有足量溶液)。
,C,D,E不变(C,E中都装有足量溶液)。
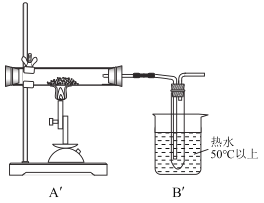
同样取一定量无水硫酸亚铁置于![]() 的石英玻璃管中进行加热,反应完毕后,从石英玻璃仪器中滞留气体排尽。观察到C中产生白色沉淀,D试管中溶液褪色。
的石英玻璃管中进行加热,反应完毕后,从石英玻璃仪器中滞留气体排尽。观察到C中产生白色沉淀,D试管中溶液褪色。
(3)实验中![]() 的玻璃管中的现象是:______,说出
的玻璃管中的现象是:______,说出![]() 装置的一个作用是:________。
装置的一个作用是:________。
最后将C中液体完全取出进行过滤、洗涤、干燥。称得所得固体质量为23.300g,所得溶液加水稀释定容为1L,取出20.00mL置于锥形瓶中,用已知浓度的标准NaOH溶液测定该1L溶液中一种溶质的浓度。
(4)上述实验过程中用到的定量仪器有_______,用到的指示剂是_______。
(5)将所得溶液加水定容时,加水所用的仪器名称为_____,若去称量![]() 玻璃管中残留固体的质量应接近于____g。
玻璃管中残留固体的质量应接近于____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的下列溶液,NH4+浓度最大的是( )
A. NH4Cl B. NH4HSO4 C. CH3COO NH4 D. NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、![]() 的混合液,经测定溶液中
的混合液,经测定溶液中![]() 与
与![]() 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的![]() 的分子个数比为( )
的分子个数比为( )
A.21:5B.11:3C.5:1D.3:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com