
【题目】下列有关化合物X(结构如图)的叙述正确的是( )

A.X分子存在2个手性碳原子
B.X分子能发生氧化、取代、消去反应
C.X分子中所有碳原子可能在同一平面上
D.1molX与足量NaOH溶液反应,最多消耗2molNaOH
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是( )


A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。放电时,该电池总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
(1)该蓄电池的负极材料是_________,放电时发生_________(填“氧化”或“还原”)反应。
(2)该蓄电池放电时,电解质溶液的酸性_________(填“增大”、“减小”或“不变”),电解质溶液中阴离子移向_________(填“正”或“负”)极。
(3)已知硫酸铅为不溶于水的白色固体,生成时附着在电极上。试写出该电池放电时,正极的电极反应_______________________________________(用离子方程式表示)。
(4)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为KOH溶液,则氢氧燃料电池的负极反应式为____________________。该电池工作时,外电路每流过1×103 mol e-,消耗标况下氧气_________m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳热还原法广泛用于合金及材料的制备。回答下列问题:
(1)一种制备氮氧化铝的反应原理为23Al2O3+15C+5N2=2Al23O27N5+15CO ,产物Al23O27N5中氮的化合价为______,该反应中每生成1 mol Al23O27N5,转移的电子数为________NA。
(2)真空碳热冶铝法包含很多反应,其中的三个反应如下:
Ⅰ.Al2O3(s)+3C(s)=Al2OC(s)+2CO(g) ΔH1
Ⅱ.2Al2OC(s)+3C(s)=Al4C3(s)+2CO(g) ΔH2
Ⅲ.2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) ΔH3
①ΔH3=_________(用ΔH1、ΔH2表示)。
②Al4C3可与足量盐酸反应制备一种烃。该反应的化学方程式为________________。
(3)下列是碳热还原法制锰合金的三个反应,CO与CO2平衡分压比的自然对数值与温度的关系如图所示(已知Kp是用平衡分压代替浓度计算所得的平衡常数)。
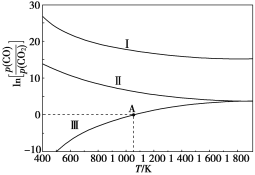
Ⅰ.Mn3C(s)+4CO2(g)![]() 3MnO(s)+5CO(g) Kp(Ⅰ)
3MnO(s)+5CO(g) Kp(Ⅰ)
Ⅱ.Mn(s)+CO2(g)![]() MnO(s)+CO(g) Kp(Ⅱ)
MnO(s)+CO(g) Kp(Ⅱ)
Ⅲ.Mn3C(s)+CO2(g)![]() 3Mn(s)+2CO(g) Kp(Ⅲ)
3Mn(s)+2CO(g) Kp(Ⅲ)
①ΔH>0的反应是____(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
②1 200 K时,在一体积为2 L的恒容密闭容器中有17.7 g Mn3C(s)和0.4 mol CO2,只发生反应Ⅰ,5 min 后达到平衡,此时CO的浓度为0.125 mol/L,则0~5 min内v(CO2)=_________。
③在一体积可变的密闭容器中加入一定量的Mn(s)并充入一定量的CO2(g),只发生反应Ⅱ,下列能说明反应Ⅱ达到平衡的是____(填字母)。
A.容器的体积不再改变 B.固体的质量不再改变 C.气体的总质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如图所示的装置实现“路线图”中的部分转化,下列叙述错误的是( )
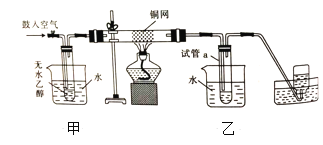
A. 铜网表面乙醇发生氧化反应
B. 甲、乙烧杯中的水均起冷却作用
C. 试管a收集的液体中至少有两种有机物
D. 实验开始后熄灭酒精灯,铜网仍能红热,说明发生的是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素的原子半径的相对大小、最高正价或最低负价的变化如下图所示,下列分析正确的是( )
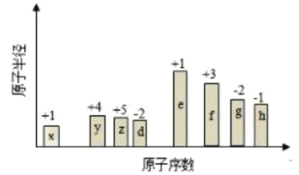
A.![]() 、
、![]() 的简单离子半径大小:
的简单离子半径大小:![]()
B.元素的金属性:![]()
C.元素的非金属性:![]()
D.![]() 、
、![]() 、
、![]() 和
和![]() 四种元素能形成离子化合物
四种元素能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol有机化合物A与标准状况下5.6L氧气混合,一定条件下二者完全反应,只得到CO、CO2和H2O三种产物,将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重5.4g,碱石灰增重4.4g,剩余气体在标准状况下的体积为2.24L,回答下列问题:
(1)写出有机化合物A的分子式___(要求写出推理过程)。
(2)若有机化合物A能与钠反应放出氢气,请写出A的结构简式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应。下列叙述不正确的是( )
A. 生成的乙酸乙酯中含有18OB. 生成的水分子中含有18O
C. 可能生成44 g乙酸乙酯D. 不可能生成90 g乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(![]() )、c(H+)均减小
)、c(H+)均减小
B.常温下,c(![]() )相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③
)相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③
C.pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)<c(NaHCO3)<c(Na2CO3)
D.某温度时水的离子积常数KW=10-13,若将此温度下pH=11的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液pH=2,则a∶b=2∶9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com