
����Ŀ��ʵ������Ҫ90mL 2.0 mol��L-1��Na2CO3��Һ��������ˮ̼���Ʒ�ĩ���ơ���ش��������⣺
��1������ʵ��Ҫ��ѡ��ʵ��������________________
A��50mL����ƿ�� B��100mL����ƿ�� C����������
D��100mL��Ͳ�� E��������ƽ�� F��ҩ��
��2����Ҫʵʩ���ƣ������������⣬��ȱ�������� ______________________��
��3������ƿ��ʹ��ǰ������еIJ�����__________________________��
��4��������Ҫ����ˮ̼���Ƶ�������Ҫ�м�����̣�___________
��5�����ƹ��̼���Ϊ���¸���������ȷ�IJ���˳��Ϊ___________________ (����������)��
A����ȴ�����£� B��ϴ�Ӳ���Һ�� C����ȡ�� D���ܽ⣻ E��ҡ��װƿ�� F�����ݣ� G����Һ
��6�������ƹ����У����������Ũ���к�Ӱ��?
������ƿ������ˮϴ����û�ȵ������������Һ���ݣ���������Һ��Ũ��___________ ������ƫ��������ƫ����������Ӱ��������ͬ����
��ת����Һʱ����С������Һ����ƿ�⣬��������Һ��Ũ��________________
�۶���ʱ�����ӿ̶��ߣ���������Һ��Ũ��________________
�����ڵμ�����ˮʱ�����������˿̶��ߣ���������Һ��Ũ��______��ʱӦ��δ�����_________
���𰸡�BCEF �ձ�����ͷ�ι� ��������ƿ�Ƿ�©ˮ 21.2g CDAGBFE ��Ӱ�� ƫ�� ƫ�� ƫ�� ��������
��������
��1������ʵ������IJ��裺�������������ܽ⡢��ȴ����Һ��ϴ����������ҡ����װƿ��ǩ�Լ�ÿ��������Ҫ����ȷ����Ӧ����������
��2������ʵ������IJ��裺�������������ܽ⡢��ȴ����Һ��ϴ����������ҡ����װƿ��ǩ�Լ�ÿ��������Ҫ����ȷ����Ӧ����������
��3������ƿ�������ӣ���ʹ��ǰ�����©��
��4������m=cVM������Ҫ̼���Ƶ�������
��5���������Ʋ����Ǽ��㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ���Բ���˳���������
��6������c=![]() ��������ʵ����ʵ���n����Һ�����V�ı仯��������������
��������ʵ����ʵ���n����Һ�����V�ı仯��������������
��1������˳���ǣ��������������ܽ⡢��ȴ����Һ��ϴ����������ҡ����װƿ��ǩ��һ������ƽ����(�õ�ҩ��)���������ձ����ܽ⣬��ȴ��ת�Ƶ�100mL����ƿ�У����ò�����������ת����ϣ�����������ˮϴ���ձ���������23�β���ϴ��Һȫ��ת�Ƶ�����ƿ�У��ټ���������ˮ������ˮ��Һ�����̶���12cmʱ�����ý�ͷ�ιܵμӣ�ʹ��Һ�İ�Һ�����͵��������ƽ������ƿ�����������µߵ�ҡ�ȡ�
������Ҫ��������������ƽ��ҩ�ס��ձ�����������100mL����ƿ����ͷ�ιܡ�
�ʴ�ΪBCEF��
��2������(1)�ķ������������������⣬����Ҫ������Ϊ�ձ��ͽ�ͷ�ιܣ��ʴ�Ϊ�ձ�����ͷ�ιܣ�
��3������ƿ�������ӣ���ʹ��ǰ�����©���ʴ�Ϊ��������ƿ�Ƿ�©ˮ��
��4��������90mL����ƿ����ѡ��100mL������ƿ����Ӧ����2mol/L��Na2CO3��Һ100mL����ҪNa2CO3������Ϊ��0.1L��2mol/L��106g/mol=21.2 g��
�ʴ�Ϊ21.2g��
��5���������Ʋ����Ǽ��㡢�������ܽ⡢��ȴ����Һ��ϴ�ӡ����ݡ�ҡ�ȡ�װƿ��֪��ȷ�IJ���˳����CDAGBFE���ʴ�ΪCDAGBFE��
��6����������ƿδ���T����������Һ������ҺŨ����Ӱ�죬��ΪֻҪ����ʱ��ȷ������ˮ��ԭ�����еĻ��Ǻ�������ģ���Ũ����Ӱ�죬�ʴ�Ϊ��Ӱ�죻
��ת����Һʱ����С������Һ����ƿ��ᵼ�����ʵ���ʧ����������Һ��Ũ��ƫ�ͣ��ʴ�Ϊƫ�ͣ�
�۶���ʱ�����ӿ̶��ߣ�����Һ���ƫС����������Һ��Ũ��ƫ�ߣ��ʴ�Ϊƫ�ߣ�
�����ڵμ�����ˮʱ�����������˿̶��ߣ�����Һ���ƫ����������Һ��Ũ��ƫ�ͣ���ʱӦ�������ƣ��ʴ�Ϊƫ�ͣ��������ơ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�����Ӧ��������������ʵ����
A. ����������ɫ��ͭ˿������ˮ�Ҵ���ͭ˿��ɺ�ɫ
����������ɫ��ͭ˿������ˮ�Ҵ���ͭ˿��ɺ�ɫ
B. �ü��������Fe(OH)3���壬���������ЧӦ
�ü��������Fe(OH)3���壬���������ЧӦ
C.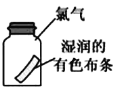 ��ʪ�����ɫ��������ʢ�и���������ƿ�У���������ɫ
��ʪ�����ɫ��������ʢ�и���������ƿ�У���������ɫ
D. ���ι��е�Ũ�������̼��������Һ�����������С���
���ι��е�Ũ�������̼��������Һ�����������С���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������ܶ�Ϊ1.25 gmL��1����������Ϊ36.5%��Ũ��������240 mL 0.1 molL��1�����ᣬ��ش��������⣺
��1��Ũ��������ʵ���Ũ��Ϊ________________________��
��2������240 mL 0.1 molL��1������
Ӧ��ȡŨ�������/mL | Ӧѡ������ƿ�Ĺ��/mL |
__________ | __________ |
��3������ʱ������ȷ�IJ���˳���ǣ�����ĸ��ʾ��ÿ����ĸֻ����һ�Σ�__________��
A����30 mLˮϴ���ձ��ڱںͲ�����23�Σ�ϴ��Һ��ע������ƿ����
B������Ͳ��ȷ��ȡ�����Ũ���������������ձ��У��ټ�������ˮ��Լ30 mL�����ò���������������ʹ���Ͼ���
C��������ȴ�������ز�����ע������ƿ��
D��������ƿ�ǽ�����ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ��Һ��ǡ����̶�������
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶���12 cm��
��4����ʵ�������������������������������ʵ���Ũ���к�Ӱ�죨�ƫ�ߡ���ƫ�͡����䡱��
������ϡ��������ձ�δϴ��__________________________________________��
������ƿ��ԭ����������ˮ____________________________________________��
�۶���ʱ���ӹ۲�Һ��________________________________________________��
��5����ʵ������г������������δ�����
�ٶ���ʱ������ˮʱ�����˿̶�________________________________________��
��������ƿ��ת����Һʱ��������Һ����________________________________��
�۶���ҡ�Ⱥ���Һ���½�____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.2,2���������1HNMR����4����
B.![]() ������ԭ�Ӵ���ͬһƽ����
������ԭ�Ӵ���ͬһƽ����
C.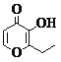 �л����һ�ַ�����ͬ���칹���ܷ���������Ӧ
�л����һ�ַ�����ͬ���칹���ܷ���������Ӧ
D.�ױ���ʹ����KMnO4��Һ��ɫ��˵���������������̼̼��������ã���KMnO4����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������װ�ý����й�Cl2��ʵ�顣����˵������ȷ����


A. ��ͼ�У�ʵ������֤��������Ư�����ã���ˮ��Ư������
B. ��ͼ�У���Cl2����ζ
C. ��ͼ�У������ػ�ɫ����
D. ��ͼ�У�������ɱ�֤��Cl2����NaOH��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��ѹǿ�£���10 L�ܱ������г���1 mol S2Cl2��1 mol Cl2��������ӦS2Cl2(g)��Cl2(g) ![]() 2SCl2(g)��Cl2��SCl2����������(v)���¶�(T)�Ĺ�ϵ��ͼ��ʾ������˵��������ȷ���ǣ� ��
2SCl2(g)��Cl2��SCl2����������(v)���¶�(T)�Ĺ�ϵ��ͼ��ʾ������˵��������ȷ���ǣ� ��
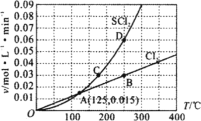
A.����Ӧ�Ļ�ܴ����淴Ӧ�Ļ��
B.�ﵽƽ����ټ��ȣ�ƽ�����淴Ӧ�����ƶ�
C.A��B��C��D�ĵ��Ӧ״̬�£��ﵽƽ��״̬��ΪB��D
D.һ���¶��£��ں����ܱ������У��ﵽƽ�����С������������´ﵽƽ���Cl2��ƽ��ת���ʲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��
2Fe(s)��O2(g) ��2FeO(s) ��H����544kJ��mol��1
4Al(s)��3O2(g) ��2Al2O3(s) ��H����3350kJ��mol��1
��2Al(s) +3FeO(s) ��Al2O3(s) + 3Fe(s)����H��
A. �� 859 kJ��mol��1 B. ��859 kJ��mol��1
C. ��1403 kJ��mol��1D. ��2491 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ij���������Է�ˮ���������Ӽ���Ũ�����±���ʾ��
���� | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
Ũ��/(mol/L) | 2��10-3 | 1��10-3 | 1��10-2 | 2��10-3 |
��1��c(H+)= mol/L��
��2��Ϊ�˼�����Ⱦ�����Ϊ��������ʦ��������������̣�����ͭ���̷���FeSO4��7H2O����

�� ��ҵ��ˮ�м������ۺ�Ӧ�����ӷ���ʽΪ��
Fe + Cu2+ == Fe2+ + Cu�� �� ��
�� �Լ�B�� ��
�� ������������Ũ������ȴ�ᾧ�� �������������ˮϴ�Ӿ��壬�ڵ����¸��
�� ͨ��������ҺD��Fe3+���жϷ�ˮ��Fe3+�Ƿ������ʵ�鷽���� ��
�� ��õ�FeSO4��7H2O���ܱձ��棬ԭ���� ��
�� ����1000 L��ˮ���������ɻ�� FeSO4��7H2O�����ʵ����� mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ƽ���л�ѧ��Ӧ����ʽ�����õ����ű�ʾ������ת�Ƶķ������Ŀ��___��
3Cu��8HNO3![]() 3Cu(NO3)2��2NO����4H2O
3Cu(NO3)2��2NO����4H2O
��2����KMnO4�������Ʊ���������Ӧ����ʽ���£�2KMnO4��16HCl(Ũ)=2KCl��2MnCl2��5Cl2����8H2O
�˷�Ӧ����������__������������__������1molKMnO4�μӷ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ__��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com