
����Ŀ�����ݻ�Ϊ1.00 L�������У�ͨ��һ������N2O4��������ӦN2O4(g)![]() 2NO2(g)�����¶����ߣ�����������ɫ���
2NO2(g)�����¶����ߣ�����������ɫ���
�ش��������⣺

��1����Ӧ�Ħ�H___0������ڡ���С�ڡ�����100��ʱ����ϵ�и�����Ũ����ʱ��仯����ͼ��ʾ����0~60 sʱ�Σ���Ӧ����v(N2O4)Ϊ______mol��L-1��s-1����Ӧ��ƽ�ⳣ��K1Ϊ________mol��L-1��
��2��100 ��ʱ�ﵽƽ��ı䷴Ӧ�¶�ΪT��N2O4��0.0020 mol��L-1��s-1��ƽ�����ʽ��ͣ���10 s�ִﵽƽ�⡣��T_______100 �棨����ڡ���С�ڡ�����
���𰸡����� 0.001 0.36 mol��L-1 ����
��������
��1�����¶�������������ɫ���˵����Ӧ������NO2�ķ����ƶ�����������Ӧ�����ƶ�����������ӦΪ���ȷ�Ӧ������H>0������v=��c/��t���㣻��������ʽ����ƽ�ⳣ��K1��
��2��ƽ��������Ӧ�����ƶ���������������ԭ�����¶����ߣ������ȷ�Ӧ�����ƶ�����������Ӧ�����ƶ�����T>100����
��1�������⼰ͼʾ֪����1.00L�������У�ͨ��0.100mol��N2O4��������Ӧ��N2O4(g)![]() 2NO2(g)�����¶�������������ɫ���˵����Ӧ������NO2�ķ����ƶ�����������Ӧ�����ƶ�����������ӦΪ���ȷ�Ӧ������H>0����ͼʾ֪60sʱ�÷�Ӧ�ﵽƽ�⣬����N2O4Ϊ0.100mol��L-1��0.040mol��L-1��0.060mol��L-1������v=��c/��t��֪��v(N2O4)= 0.060mol��L-1/60s��0.0010mol��L-1��s-1��
2NO2(g)�����¶�������������ɫ���˵����Ӧ������NO2�ķ����ƶ�����������Ӧ�����ƶ�����������ӦΪ���ȷ�Ӧ������H>0����ͼʾ֪60sʱ�÷�Ӧ�ﵽƽ�⣬����N2O4Ϊ0.100mol��L-1��0.040mol��L-1��0.060mol��L-1������v=��c/��t��֪��v(N2O4)= 0.060mol��L-1/60s��0.0010mol��L-1��s-1��
��ƽ�ⳣ������������ʽ��
N2O4(g)![]() 2NO2(g)
2NO2(g)
��ʼ��/(mol��L-1) 0.100 0
ת����/(mol��L-1) 0.060 0.120
ƽ����/(mol��L-1) 0.040 0.120
K1=c2��NO2��/c��N2O4��=��0.120mol��L-1��2/0.040mol��L-1=0.36mol��L-1��
�ʴ�Ϊ��������0.001��0.36 mol��L-1��
(2)100��ʱ��ƽ��ı䷴Ӧ�¶�ΪT��N2O4��0.0020mol��L-1��s-1��ƽ�����ʽ��ͣ���10s�ִﵽƽ�⣬˵��ƽ��N2O4(g)![]() 2NO2(g)������Ӧ�����ƶ���������������ԭ�����¶����ߣ������ȷ�Ӧ�����ƶ�����������Ӧ�����ƶ�����T>100����
2NO2(g)������Ӧ�����ƶ���������������ԭ�����¶����ߣ������ȷ�Ӧ�����ƶ�����������Ӧ�����ƶ�����T>100����
�ʴ�Ϊ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0��1000mol/L��NaOH��Һ�ζ�20mlͬŨ�ȵ�һԪ����HA���ζ�������ҺpH��X�ı仯������ͼ��ʾ�������к���ЧӦ��������˵������ȷ����

A. HA��Һ��ˮϡ�ͺ���Һ��c(HA)/c(A-)��ֵ��С
B. HA�ĵ��볣��KHA=10-7x/(100-x)��xΪ�ζ�������
C. ���ζ�����Ϊ100ʱ����Һ��ˮ�ĵ���̶����
D. �ζ���������100ʱ����Һ������Ũ�ȹ�ϵ��c��Na����>c��A-��>c��OH����>c��H����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ(CuC1)���л��ϳ���Ӧ�ù㷺�Ĵ�����������ˮ���������Ҵ���¶���ڳ�ʪ�Ŀ������ױ����������ڸ���Ŀ������ȶ��������ֽ⡣ʵ�����Ʊ��Ȼ���ͭ�Ĺ������£�
�����ͼװ�������ԣ�����������ƿ�м���ͭ˿���Ȼ��������ᡢ���ᣬ�ر�K��
������50��ʱֹͣ���ȣ�ͭ˿���������ɫ���ݣ�Һ���Ϸ�������Ϊ����ɫ�����ҹ���
��K��ͨ�������������ұ��ƿ�ں���ɫ������ʧʱ�ر�K����ȴ�����£��Ƶ�NH4[CuCl2]��
������Һ��ת�����ձ�������������ˮϡ�ͣ�������ɫ���������˵��Ȼ���ͭ��Ʒ����Һ��
V����Ʒ��95%�Ҵ�ϴ�ӡ���ɵ��Ȼ���ͭ��

��ش��������⣺
(1)ʵ������CuC1�ı��淽����___________��
(2)ʵ�鿪ʼʱ���¶ȼ���ʾ��ӦҺ�¶ȵ������£���Ҫԭ����___________��
(3)ͨ��������Ŀ����___________��Ϊ���ڹ۲�Ϳ��Ʋ���O2�����ʣ��Ʊ�������װ�����ѡ��___________(����ĸ)

(4)����ƿ������NH4[CuCl2]���ܷ�Ӧ�����ӷ���ʽΪ_______��������в�����ɫ�����Ļ�ѧ����ʽΪ_______��
(5)����V��ϴ��ʱ�Լ�ѡ��95%�Ҵ���ԭ����___________��
(6)CuCl���Ȳⶨ����ȡ��Ʒ0.25g����Ԥ�ȷ��벣����30����10mL������FeCl3��Һ����ƿ�У�����ҡ��������Ʒ�ܽ��ˮ50mL��ָʾ��2�Σ�������0.10mol��L��1���������Һ�ζ����յ㲢��¼���������ظ�ʵ�����Σ�����������±���(��֪��CuC1+FeCl3=CuCl2+FeCl2��Fe2++Ce4+=Fe3++Ce3+)

�ٲ������������___________��
��CuCl�Ĵ���Ϊ___________(������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ظ���س������л��ϳɵ��������ʹ����ȡ��ɺ�����Һ(��Ҫ��Cr3+��Fe3+��K+��SO42-��)�Ʊ�K2Cr2O7����������ͼ��ʾ��

��֪��I �����������£�H2O2�ܽ�Cr2O72-��ԭΪCr3+
II��ؽ��������γ��������������pH��Χ���£�
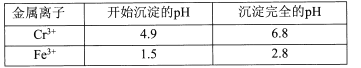
�ش��������⣺
(l)�����ڵ���Ҫ�ɷ�Ϊ____(�ѧʽ)��
(2)д���������������з�Ӧ�Ļ�ѧ����ʽ____��
(3)��������������Ŀ����____��
(4)���ữ�������з�����Ӧ2CrO42-+2H+![]() Cr2O72-+H2O (K=4��1014L3.mol3)��֪�����ữ������Һ��c(Cr2O72-)=1.6��10-3mol/L����Һ��c(CrO42-)=____
Cr2O72-+H2O (K=4��1014L3.mol3)��֪�����ữ������Һ��c(Cr2O72-)=1.6��10-3mol/L����Һ��c(CrO42-)=____
(5)���ᾧ����õ�K2Cr2O7(M=294g.mol-1)��Ʒ0.5000 g�������ܽ����ϡH2SO4�ữ������Ũ��Ϊ1.0000 mol.L-l (NH4)2Fe(SO4)2 ����Һ�ζ����ζ��յ����ı���Һ�����Ϊ9.00 mL�����Ʒ�Ĵ���Ϊ____��[�ζ���ӦΪ��K2Cr2O7+6(NH4)2Fe(SO4)2+7H2SO4 =K2SO4 +Cr2(SO4)3 +6(NH4)2SO4+3Fe2(SO4)3+7H2O]
(6)��K2Cr2O7�����£�����������绯ѧ����ʵ�ֺ����ӷ�ˮ����Ч�������乤��ԭ������ͼ��ʾ��

�ٸ����ĵ缫��ӦʽΪ____��
��һ��ʱ����м�����NaCl��Һ��Ũ��____(����������������С������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���佺��һ����Ȼ����ҩ����Ҫ���Գɷ�Ϊ�����ᱽ����(J)���ϳɻ�����I��·�����£�

��֪����
��RCHO+HOOCCH2COOH![]() RCH=CHCOOH
RCH=CHCOOH
�۵��ǻ���˫��̼ԭ������ʱ������ת����RCH-CHOH=RCHCHO
��ش��������⣺
(l)������F��������____;B-C�ķ�Ӧ������____��
(2)������E�к��������ŵ�������____��G-H�ķ�Ӧ�����Լ��������ֱ���____��____��
(3)д��������C������Cu(OH)2����Һ��Ӧ�Ļ�ѧ����ʽ____��
(4)������W��E��Ϊͬ���칹�壬���������������������Ŀ��ȫ��ͬ���ұ�������3��ȡ��������W���ܵĽṹ��____��(������˳���칹)�����к˴Ź���������ʾ��6�ֲ�ͬ��ѧ�������⣬�������Ϊ2:2:1��1:1:1��д������Ҫ���W�Ľṹ��ʽ____��
(5)���������ϳ�·�ߣ������CH3CH=CH2��HOOCCH2COOHΪԭ���Ʊ� CH3CH2CH=CHCOOH�ĺϳ�·��(���Լ���ѡ)____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ʵ�������صļ��㡣
��1����״���£�33.6LCO2�����ʵ���Ϊ___mol������Ϊ___g������Oԭ�ӵ���Ŀ��____����
��2��ͬ��ͬѹ�£�ͬ����İ���NH3�������⣨H2S�����������֮����____��ͬ�����İ�����������������ԭ�Ӹ���֮����___��
��3��agCl2����b����ԭ�ӣ����ӵ�����NA����ֵ�ɱ�ʾΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��������Ȼ���������ص��ƻ����ã�������ˮ��Ⱦ�����̲��ݻ���
��1��ij�����������ķ�ˮ�к���Fe2����Mn2+�Ƚ������ӣ����ù������[(NH4)2S2O8]������ȥ��
�ٹ��������Mn2+��Ӧ����MnO2�����ӷ���ʽΪ________________��
���¶���Fe2+��Mn2+�����̶�֮��Ĺ�ϵ��ͼ1��ʾ��

ͼ1
ʵ�������Ӧ���¶ȿ�����________________��Fe2+��Mn2+���������γɽ�����״���ӣ����������̿�������������̿��Ŀ��Ϊ________________��
��H2O2Ҳ�н�ǿ�����ԣ���ʵ�������в���H2O2����Mn2+��ԭ����________________��
��2������ij����ɸ��������NH3���ѳ�������NO��NO2���䷴Ӧ������ͼ2��ʾ��A�������ʵĻ�ѧʽΪN2��________________��


ͼ2 ͼ3
��3����ҵ�Ϸ�����SO2����Na2CO3��Һ���գ���Ӧ��������Һ��ɱ仯��ͼ3��ʾ��
�����ճ��ڣ�ͼ��A����ǰ����Ӧ�Ļ�ѧ����ʽΪ________________��
��C�����B���ԭ����________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��400 ��ʱ����һ������SO2�� 14 mol O2ѹ��һ��ʢ�д�����10 L�ܱ������н��з�Ӧ��2SO2��O2 ![]() 2SO3
2SO3
��֪ 2 min��������ʣ�� 2 mol SO2��12 mol O2���Լ��㣺
��1������SO3�����ʵ�����______
��2��SO2����ʼ���ʵ���Ũ�ȡ�______
��3��2 min ��SO2��SO3�ķ�Ӧ���ʡ�______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T��ʱ��ˮ�����ӻ�ΪKw�����¶��½�a mol/LһԪ��HA��Һ��b mol/LһԪ��BOH��Һ�������ϣ�����Ϻ���Һ�����ԣ�������˵��һ����ȷ���ǣ� ��
A. ���Һ�У�c(H+) = ![]() B. ���Һ��pH=7
B. ���Һ��pH=7
C. ���Һ�У�c(B+) = c(A��) + c(OH��) D. a = b
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com