
【题目】某无色溶液中可能含有Ba2+、Fe3+、Na+、K+、NH4+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol/L.往该溶液中加入BaCl2和过量的盐酸,无白色沉淀生成。另取少量原溶液,设计并完成如下实验。下列判断正确的是( )
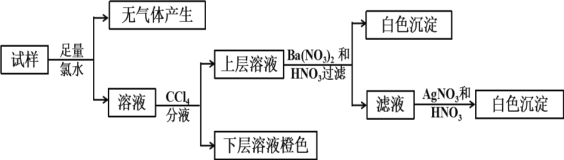
A.Ba2+、Fe3+、SO42-、CO32-肯定不存在,Na+、K+肯定存在
B.原溶液肯定不含SO42-和SO32-
C.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,对溶液中离子的判断有影响
D.是否含NH4+需另做实验判断
【答案】A
【解析】
无色溶液中一定不含Fe3+,该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成,无SO42-;加足量氯水,无气体,无CO32-,溶液加四氯化碳分液,下层橙色,则有Br-,上层加硝酸钡和稀硝酸有白色沉淀,有SO32-,无Ba2+,溶液中一定含阳离子,且离子浓度都为0.1molL-1,根据电荷守恒,一定含有NH4+、Na+、K+,一定不存在Cl-,滤液中加硝酸酸化的硝酸银有白色沉淀,是过程中加氯水时引入的氯离子,结合溶液为电中性来解答。
A. 分析可知,肯定不存在的离子:Ba2+、Fe3+、SO42-、CO32-,一定含:NH4+、Na+、K+,A正确;
B. 原溶液肯定不含SO42-,但含有SO32-,B错误;
C. 加入Ba(NO3)2和HNO3溶液目的是检验硫酸根离子,若改用BaCl2和盐酸的混合溶液,对溶液中离子的判断无影响,C错误;
D. 根据电荷守恒,一定含有NH4+,D错误;故答案为:A。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】CO常用于工业冶炼金属。在不同温度下CO还原四种金属氧化物达平衡后气体中![]() 与温度
与温度![]() 的关系曲线如图。下列说法正确的是
的关系曲线如图。下列说法正确的是
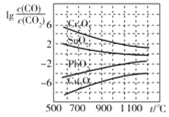
A.通过增高反应炉的高度,增大矿石和CO接触面积,能减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属Cr
C.CO还原![]() 的反应
的反应![]()
D.工业冶炼金属Cu时,高温有利于提高CO的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气变换反应是重要的化工过程,反应方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH。我国科学家在这一变换中利用双功能催化剂突破了低温下高转化率与高反应速率不能兼得的难题。反应历程如图所示:

下列说法错误的是( )
A.该反应ΔH<0
B.根据历程图示过程Ⅰ为吸热过程、过程Ⅲ为放热过程
C.整个历程中两个H2O分子都参与了反应
D.使用双功能催化剂降低了水煤气变换反应的ΔH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性工业废水中含有![]() ,光照下,草酸
,光照下,草酸![]() 能将其中的
能将其中的![]() 转化为
转化为![]() 某课题组研究发现,少量铁明矾
某课题组研究发现,少量铁明矾![]() 即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,
即可对该反应起催化作用,为进一步研究有关因素对该反应速率的影响,
探究如下:在![]() 下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,具体数据如表:
下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,具体数据如表:
实验编号 | 初始pH | 废水样品体积 | 草酸溶液体积 | 蒸馏水体积 |
| 4 | 60 | 10 | 30 |
| 5 | 60 | 10 | 30 |
| 5 | 60 | 15 | 25 |
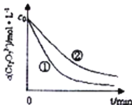
测得实验![]() 和
和![]() 溶液中的
溶液中的![]() 随时间变化关系如图所示.
随时间变化关系如图所示.
(1)实验![]() 和
和![]() 的结果表明 ______ .
的结果表明 ______ .
(2)根据实验![]() 和
和![]() ,画出实验
,画出实验![]() 中
中![]() 随时间变化的趋势图._____________
随时间变化的趋势图._____________
(3)该课题组对铁明矾![]() 中起催化作用的成分提出如下假设,请你完成假设二和假设三:
中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:![]() 起催化作用;
起催化作用;
假设二: ______ ;
假设三: ______ ;
![]()
(4)设计实验验证上述假设一,可选用下列物质代替少量铁明矾![]()
的是 ______ ![]()
![]()
![]() ,
,![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,可逆反应![]() 在体积固定的密闭容器中反应,达到平衡状态的标志是( )
在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成nmolO2,同时生成2nmol![]()
②混合气体的压强不再改变
③混合气体的平均相对分子质量不再改变
④单位时间内生成nmolO2,同时生成2nmolNO
⑤混合气体的颜色不再改变
⑥用![]() 、NO、
、NO、![]() 的物质的量浓度变化表示的反应速率的比为2:2:1
的物质的量浓度变化表示的反应速率的比为2:2:1
A.①④⑤⑥B.①②③⑤C.②③④⑥D.以上全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求答题:
(l)食品和药物安全是国家高度重视的民生问题。根据题意,用下列选项的字母代号填空。
A.阿司匹林(乙酸水杨酸) B.青霉素 C.抗酸药(氢氧化铝) D.麻黄碱
①治疗胃酸过多,但患有严重的胃溃疡,应该选择_______;
②是一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是_______;
③能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是_______。
(2)钢铁是目前用量最大、用途最广的合金材料,在潮湿空气中容易发生腐蚀。请写出钢铁发生电化学腐蚀的负极反应式_______________________________________。
(3)材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础。材料种类很多,通常可分为金属材料、无机非金属材料、高分子合成材料及复合材料, 生活中的玻璃、陶瓷、水泥属于上述材料中的______________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的化学方程式或离子方程式正确的是
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓
B.实验室用液溴和苯在催化剂作用下制溴苯:![]() + Br2
+ Br2![]()
![]() +HBr
+HBr
C.实验室用乙醇制乙烯:CH3CH2OH CH2=CH2↑+H2O
CH2=CH2↑+H2O
D.少量苯酚与浓溴水的反应:![]() +3Br2
+3Br2![]()
 ↓+3HBr
↓+3HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
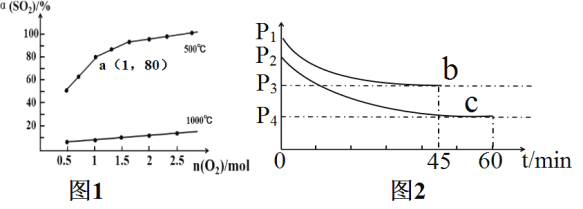
【题目】催化氧化反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0。在体积可变的密闭容器中,维持压强为1.01×105Pa,充入2molSO2和一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
2SO3(g) △H<0。在体积可变的密闭容器中,维持压强为1.01×105Pa,充入2molSO2和一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
已知反应aA(g)+bB(g)![]() gG(g)+hH(g)的标准平衡常数Kθ=
gG(g)+hH(g)的标准平衡常数Kθ= ,其中Pθ=1.01×105Pa,PG,PH,PA,PB分别表示G,H,A,B的分压,P(分压)=P(总压)×物质的量分数。
,其中Pθ=1.01×105Pa,PG,PH,PA,PB分别表示G,H,A,B的分压,P(分压)=P(总压)×物质的量分数。
(1)在绝热恒容的密闭容器中,能表明反应2SO2(g)+O2(g)![]() 2SO3(g)已达到平衡状态的是___。
2SO3(g)已达到平衡状态的是___。
A.v(SO2)=2v(O2)
B.当容器内温度不再变化时
C.各组分的物质的量相等
D.容器内气体密度不变
E.混合气体的平均相对分子质量不变
(2)在1000℃时随着O2物质的量的增大,但SO2平衡转化率升高缓慢,其原因是___。
(3)求图1中a点的标准平衡常数Kθ=___。在a点达到平衡后,若保持温度、压强不变,再向体系中充入SO2(g),O2(g),SO3(g)各0.2mol时,此时v(正)___v(逆)(填“<”“>”或“=”)。
(4)若在相同的恒容密闭容器中充入O2和SO2各2mol,在不同温度下达到平衡,反应体系总压强随时间变化如图2所示,则达到平衡状态b和c时,SO3体积分数较大的是___(填“b”或“c”),原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:

(1)图中A、C分别表示______、______,E的大小对该反应的反应热有无影响?_______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是________________________;
(2)图中△H=__KJ·mol-1;
(3)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H__(要求写计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com