
【题目】某烧碱样品含有少量不与酸作用的杂质,为了滴定其纯度,进行以下滴定操作:
A.在天平上准确称取烧碱样品10g,在烧杯中用蒸馏水溶解
B.用移液管(或碱式滴定管)量取25mL烧碱溶液于锥形瓶中滴加几滴酚酞作指示剂
C.在1000mL的容量瓶中配制1000mL烧碱溶液
D.将物质的量浓度为0.5 mol/L的标准硫酸溶液装入酸式滴定管,调整液面记下开始读数为V1mL
E.在锥形瓶下一张白纸,滴定至红色刚好消失为止,记下读数V2mL
回答下列问题:
(1)正确操作步骤的顺序是(填字母): → → → → E。__
(2)滴定前俯视或滴定后仰视 _____ 滴定接近终点时,有少量蒸馏水冲洗锥形瓶内壁 _____(填“偏高”、“偏低”或“无影响”)
(3)操作E中的锥形瓶下垫一张白纸的作用是___________________________。
(4)开始时标准液在滴定管刻度线以上,未予调整 ____(填“偏高”“偏低”或“无影响”)
(5)滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失______未用标准液润洗滴定管_____(填“偏高”、“偏低”或“无影响”)
(6)该烧碱样品纯度为: ____________ 。(样品中烧碱的质量/样品的质量×100%)
【答案】A→C →B →D →E 偏高 无影响 便于观察锥形瓶中溶液颜色变化 偏低 偏高 偏高 16(V2-V1)%
【解析】
(1)根据准确配制一定物质的量浓度的溶液的步骤分析;
(2)根据物质的量浓度定义式c=![]() ,通过测定对溶液的体积、溶质的物质的量分析;
,通过测定对溶液的体积、溶质的物质的量分析;
(3)酸碱中和滴定关键是滴定终点的判断;
(4)反应消耗的酸标准溶液的体积是V2-V1,根据物质的量浓度定义式分析误差;
(5)滴定前有气泡使V1偏小,未润洗,会导致滴定的标准溶液被稀释,浓度降低;
(5)根据消耗标准盐酸溶液的体积与浓度的乘积得到HCl的物质的量,结合HCl与NaOH物质的量相等,得NaOH的物质的量,在根据n=![]() 计算其质量,最后根据
计算其质量,最后根据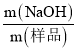 ×100%计算纯度。
×100%计算纯度。
(1)某烧碱样品含有少量不与酸作用的杂质,为了滴定其纯度,首先在天平上准确称取烧碱样品10g,在烧杯中用蒸馏水溶解,然后在1000mL的容量瓶中配制1000mL烧碱溶液,用移液管(或碱式滴定管)量取25mL烧碱溶液于锥形瓶中滴加几滴酚酞作指示剂,将物质的量浓度为0.5 mol/L的标准硫酸溶液装入酸式滴定管,调整液面记下开始读数为V1 mL,在锥形瓶下一张白纸,滴定至红色刚好消失为止,记下读数V2 mL,然后计算其中含有的NaOH的质量,进而可得物质中含有的烧碱纯度;故操作顺序为A→C →B →D →E;
(2)滴定前俯视或滴定后仰视则消耗的标准酸溶液的体积偏大,NaOH的物质的量偏多,则根据c=![]() 可知溶液的烧碱的含量偏高;若在滴定接近终点时,有少量蒸馏水冲洗锥形瓶内壁,由于没有改变溶液中NaOH的物质的量,因此对测定结果无影响;
可知溶液的烧碱的含量偏高;若在滴定接近终点时,有少量蒸馏水冲洗锥形瓶内壁,由于没有改变溶液中NaOH的物质的量,因此对测定结果无影响;
(3)操作E中的锥形瓶下垫一张白纸的作用是便于观察锥形瓶中溶液颜色变化,以便准确判断滴定终点;
(4)开始时标准液在滴定管刻度线以上未予调整,导致消耗标准酸溶液的体积偏小,由此计算的烧碱样品中NaOH的含量偏低;
(5)滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失则V1偏小,消耗标准酸溶液的体积(V2-V1)就会偏大,导致NaOH的含量偏高;若未用标准液润洗滴定管,标准溶液被稀释,浓度降低,则消耗标准酸溶液的体积偏大,由此计算的NaOH的浓度偏高;
(6)25mL烧碱溶液滴定消耗的HCl的物质的量是n(H2SO4)=cV=0.5mol/L(V2-V1)×10-3L=5(V2-V1)×10-4mol,根据H2SO4+2NaOH=Na2SO4+2H2O,则n(NaOH)=2n(H2SO4)= (V2-V1)×10-3mol,则10g样品配成的1000mL溶液中含有烧碱的物质的量是n(NaOH)=(V2-V1)×10-3mol×![]() =4(V2-V1)×10-2mol,所以该烧碱样品纯度为
=4(V2-V1)×10-2mol,所以该烧碱样品纯度为![]() ×100%=16(V2-V1)%。
×100%=16(V2-V1)%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为检验淀粉水解的情况,进行如图所示的实验,试管甲和丙均用60~80℃的水浴加热5~6min,试管乙不加热。
待试管甲中的溶液冷却后再进行后续实验。
实验①:取少量甲中溶液,加入新制氢氧化铜,加热,没有砖红色沉淀出现。
实验②:取少量乙中溶液,滴加几滴碘水,溶液变为蓝色,但取少量甲中溶液做此实验时,溶液不变蓝色。
实验③:取少量丙中溶液加入氢氧化钠溶液调节至碱性,再滴加碘水,溶液颜色无明显变化。
(1)写出淀粉水解的化学方程式_____________________。
(2)设计甲和乙是为了探究________对淀粉水解的影响,设计甲和丙是为了探究________对淀粉水解的影响。
(3)实验①失败的原因是_____________________________。
(4)实验③中溶液的颜色无明显变化的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
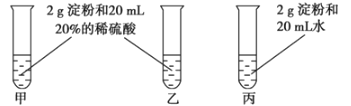
【题目】通常状况下,CO是一种无色、无味、有毒的气体,难溶于水,与酸、碱、盐溶液均不反应。酒精喷灯可用作高温热源。正确连接如图所示的装置进行实验,可以验证某混合气体的成分是CO2和CO(每套装置限用一次)。请回答下列问题:
(1)连接装置导管口的顺序:混合气体→__________________→尾气处理(填导管接口代号)。
(2)证明原混合气体中CO2存在的实验现象是__________________________________;
证明CO存在的有关反应的化学方程式是__________________________________________。
(3)有同学提出仪器B应再使用一次,你认为有道理吗?________(填“有”或“没有”),并简述理由:
_________________________________________________________________。
(4)本实验尾气处理的方法是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
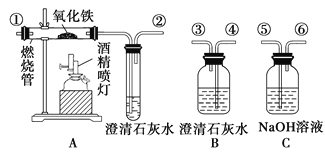
【题目】已知实验室以乙醇为原料来制备乙酸乙酯时,经历了下面三步反应:
下列说法正确的是
A.乙醇和乙醛能发生氧化反应,乙酸和乙酸乙酯则不能被氧化
B.上述①、②、③的反应类型分别是氧化反应、加成反应和取代反应
C.上述乙醇、乙酸和乙酸乙酯都具有同分异构体
D.工业上可以通过石油分馏的方法获得乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,A(g)+3B(g)![]() 5C(g) ΔH>0,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是
5C(g) ΔH>0,达到甲平衡。在仅改变某一条件后,达到乙平衡,改变的这一条件是

A.加入适当催化剂B.增大压强C.增大反应物的浓度D.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择性催化还原是在有催化剂的条件下将NOx转变为N2和H2O,这是目前国外硝酸厂进行尾气治理普遍采用的一种方法,某小组同学拟验证NO能被氨气还原并测算其转化率。
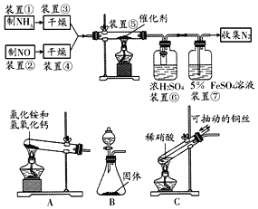
请回答下列问题:
(1)若制取氨气用A装置,则发生反应的化学方程式为_______,若用B装置制取氨气,则分液漏斗和锥形瓶中盛放的药品分别是______、________;
(2)用C装置制取NO时,用可抽动的铜丝,其优点是_______,其反应的离子方程式为________;
(3)装置⑦的作用可能是____________;
(4)若进入装置⑤的NO共2688mL(标况下),氨气过量,最后收集到标况下2016mLN2,则NO的转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌、消炎作用的黄酮醋酸类化合物L的合成路线如下图所示:
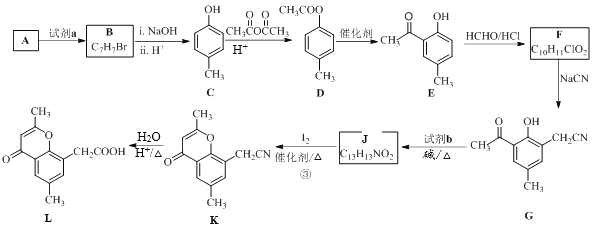 已知部分有机化合物转化的反应式如下:
已知部分有机化合物转化的反应式如下:
i.R-X![]() R-CN
R-CN![]() R-COOH(R为烃基)
R-COOH(R为烃基)
ii.RCHO+CH3COR′![]() RCH=CHCOR′(R、R′代表烃基或氢)
RCH=CHCOR′(R、R′代表烃基或氢)
iii.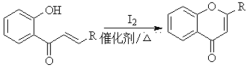 (R代表烃基或氢)
(R代表烃基或氢)
(1)A的分子式是C7H8,其结构简式是______;A→B所属的反应类型为______。
(2)试剂a是_______________。
(3)C→D的化学方程式是___________________。
(4)F的结构简式是__________;试剂b是___________。
(5)J与I2反应生成K和HI的化学方程式是____________。
(6)以A和乙烯为起始原料,结合题中信息,选用必要的无机试剂合成苯乙酸乙酯(![]() ),参照下列模板写出相应的合成路线_______________。
),参照下列模板写出相应的合成路线_______________。
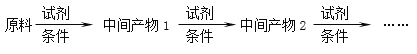
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2A(g)![]() 2Y(g) + E(g)ΔH>0达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
2Y(g) + E(g)ΔH>0达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是( )
A.加压B.减压C.减小E的浓度D.降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】照相底片定影时,常用定影液硫代硫酸钠(![]() )溶解未曝光的溴化银(
)溶解未曝光的溴化银(![]() ),生成含
),生成含![]() 的废定影液再向其中加入
的废定影液再向其中加入![]() 使
使![]() 中的银转化为
中的银转化为![]() ,使定影液再生。将
,使定影液再生。将![]() 在高温下转化为Ag,达到回收银的目的。回答下列问题:
在高温下转化为Ag,达到回收银的目的。回答下列问题:
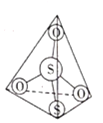
(1)元素周期表中,铜、银、金位于同一副族相邻周期,则基态银原子的最外层电子排布式为__________________。
(2)![]() 离子结构如图所示,其中心硫原子的杂化方式为___________。基态S原子中,核外电子占据的最高能级的符号是__________,占据最高能级电子的电子云轮廓图为________形。
离子结构如图所示,其中心硫原子的杂化方式为___________。基态S原子中,核外电子占据的最高能级的符号是__________,占据最高能级电子的电子云轮廓图为________形。
(3)写出![]() 溶于
溶于![]() 溶液反应的离子方程式______。
溶液反应的离子方程式______。![]() 中存在的作用力有离子键、共价键、__________。
中存在的作用力有离子键、共价键、__________。
(4)在空气中灼烧![]() 生成
生成![]() 和
和![]() ,
,![]() 分子的空间构型为__________。分子中的大
分子的空间构型为__________。分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数n代表参与形成大
键的原子数n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则
),则![]() 中的大
中的大![]() 键应表示为_________。
键应表示为_________。
(5)![]() 的键角小于
的键角小于![]() 的键角,原因是_________________。
的键角,原因是_________________。
(6)用X射线衍射法可测定阿伏加德罗常数。由金的X射线衍射图像可知金的晶胞属于面心立方晶胞。若金原子的半径为![]() ,金的密度为
,金的密度为![]() ,摩尔质量为
,摩尔质量为![]() ,列出计算阿伏加德罗常数的算式_________(用含
,列出计算阿伏加德罗常数的算式_________(用含![]() 的表达式表示)。
的表达式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com