
【题目】在一定条件下,向密闭容器中加入一定量的C(s)与H2O(g)发生可逆反应C(s) + H2O(g)![]() CO(g) + H2(g),反应达到平衡后C(s)与H2O(g)转化率为2:1关系,则下列说法正确的是
CO(g) + H2(g),反应达到平衡后C(s)与H2O(g)转化率为2:1关系,则下列说法正确的是
A.开始加入的C(s)与H2O(g)物质的量为2:1
B.若增大压强,H2O(g)转化率不变化
C.达到平衡后混合气体平均式量可能为16
D.开始反应后混合气体平均式量一直减小
科目:高中化学 来源: 题型:
【题目】室温下,pH 均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH 随溶液体积的变化曲线如图所示。下列说法正确的是

A. HA的酸性比HB的酸性弱
B. a点溶液的导电性比c点溶液的导电性弱
C. 若两溶液加水稀释,则所有离子的浓度都减小
D. 对a、b两点溶液同时升高温度,则c(A-)/c(B-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84 g·cm-3)配制250 mL0.4 mol·L-1稀硫酸,有以下实验仪器供选:A 10mL量筒 B 托盘天平 C 玻璃棒 D 250 mL容量瓶 E 500 mL容量瓶 F 胶头滴管 G. 烧杯
(1)需量取浓硫酸的体积为___________mL。
(2)实验时不可选用的仪器有(填序号) __________________。
(3)配制过程中,下列情况会使配制结果偏高的是_____(填序号)
①容量瓶使用时未干燥;
②定容时俯视刻度线观察液面;
③将浓硫酸在烧杯中稀释后未经冷却就转移至容量瓶中,并定容;
④定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线。
(4)配置过程中,实验操作步骤为: __________
A.在烧杯中注入蒸馏水(溶液体积少于250mL),沿烧杯壁注入量取的浓硫酸用玻璃棒搅拌,使其混匀。
B.待稀释的硫酸冷却后,沿玻璃棒注入250mL的容量瓶中。
C.用量筒量取密度为1.84g/cm3质量分数为98%的浓硫酸。
D.用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中。
E.往容量瓶中小心加蒸馏水至液面接近刻度1-2cm处,改用胶头滴管加蒸馏水,使溶液凹液面恰好与刻度线相切。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)由工业合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,涉及以下四个可逆反应:
甲醇合成反应:
(i)CO(g) +2H2(g)==CH3OH(g) △H 1=-90.1kJ·mol-1;
(ii)CO2(g)+3H2(g)== CH3OH(g) +H2O(g) △H2=-49.0kJ·mol-1;
水煤气变换反应:(iii)CO(g)+ H2O(g)==CO2(g)+ H2(g) △H3=-41.1kJ·mol-1;
二甲醚合成反应:(iv)2CH3OH(g) ==CH3OCH3(g)+ H2O(g) △H4=-24.5kJ·mol-1;
①由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为____________________________。根据化学反应原理,分析增大压强对直接制备二甲醚反应的影响:___________________________________。
②反应( ii )的平衡常数表达式为K=______________。
(2)现以二甲醚燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72-),实验室利用如图2装置模拟该法:

①M电板(a为CO2)的电极反应式为________________________;电解池阳极的电极反应式为_______________________________________。
②请写出电解池中Cr2O72-转化为Cr3+的离子反应方程式:__________________________。
③已知25 ℃时,Ksp[Cr(OH)3]=6.4×10-31。一般以离子浓度≤1×10-5 mol/L作为该离子除尽的标准。处理废水时,最后Cr3+以Cr(OH)3形式除去,当溶液的pH=6时,c(Cr3+)=______,Cr3+ ___ (填“是”或“否”)被除尽。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、M是原子序数依次增大五种元素,基态X原子的s电子数比p电子数多3个,在周期表中Y与Z相邻且第一电离能Y>Z,Z、R同主族,M核外电子有29种运动状态,请回答下列问题:
(1)基态M2+的电子排布式为__________,X、Y、Z、M的电负性由大到小的顺序为__________。
(2)化合物XCl3的中心原子杂化类型为__________;YCl3的立体构型为__________,XCl3、YCl3分子中属于非极性分子的是__________。
(3)H2Z、H2Z2、H2R的沸点分别为100℃、158℃,-60.4℃,试解释此种现象____________。
(4)H2RO3的K1和K2分别为1.54×10-2和1.02×10-7,熔融化状态下RO3不能导电而Na2O能导电,请根据结构与性质的关系解释下列问题:
①K1>K2:____________。
②RO3不能导电而Na2O能导电:____________。
(5)Z、M形成的一种化合物晶胞如图所示: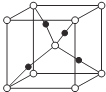 (实心球代表M)
(实心球代表M)
①该化合物的化学式为_______________。
②若晶胞参数为apm。列式计算该晶胞的密度籽=____g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体。火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
①如图是一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“” ___。
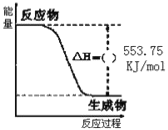
②写出表示丙烷燃烧热的热化学方程式:___。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为___。
(2)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g)═H2O(l) △H1=Q1kJ/mol
C2H5OH(g)═C2H5OH(l) △H2=Q2kJ/mol
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g) △H3=Q3kJ/mol
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为___kJ。
②碳(s)在氧气供应不充分时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+![]() O2(g)═CO(g)的△H.但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有___。
O2(g)═CO(g)的△H.但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 将1mol Cl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA
B. 100g CaCO3晶体和100g KHSO4晶体中含有的离子数分别为2NA和3NA
C. 标准状况下,4.48L NO和2.24L O2混合后,原子总数为0.6NA
D. 已知3BrF3 + 5H2O=HBrO3 + Br2 + 9HF + O2↑,若有5mol H2O参加反应,则被水还原的BrF3分子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼![]() 最重要的用途是作为铁合金的添加剂,用CO还原
最重要的用途是作为铁合金的添加剂,用CO还原![]() 制备单质Mo的装置如图所示
制备单质Mo的装置如图所示![]() 尾气处理装置已省略
尾气处理装置已省略![]() 下列说法正确的是
下列说法正确的是![]()
![]()
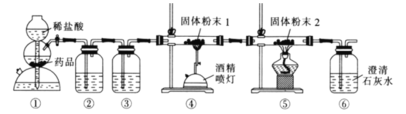
A.装置![]() 中的药品为石灰石粉末
中的药品为石灰石粉末
B.装置![]() 中盛有饱和碳酸氢钠溶液,
中盛有饱和碳酸氢钠溶液,![]() 中盛有澄清石灰水
中盛有澄清石灰水
C.在装置![]() 中生成了钼单质
中生成了钼单质
D.![]() 中溶液变浑浊,说明产生的
中溶液变浑浊,说明产生的![]() 一定是来自
一定是来自![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com