
【题目】[化学一选修3:物质结构与性质]我国具有悠久的历史,在西汉就有湿法炼铜(Fe+CuSO4=Cu+FeSO4),试回答下列问题。
(1)Cu2+的未成对电子数有______个,H、O、S电负性由大到小的顺序为_______。
(2)在硫酸铜溶液中滴加过量氨水可形成[Cu(NH3)4]SO4蓝色溶液。
①[Cu(NH3)4]SO4中化学键类型有_______,[Cu(NH3)4]2+的结构简式为_______,阴离子中心原子杂化类型为______。
②氨的沸点远高于膦(PH3),原因是______________。
(3)铁铜合金晶体类型为_____;铁的第三(I3)和第四(I4)电离能分别为2957kJ/mol、5290kJ/mol,比较数据并分析原因________________。
(4)金铜合金的一种晶体结构为立方晶型,如图所示。

①该合金的化学式为____;
②已知该合金的密度为dg/cm3,阿伏加德罗常数值为NA,两个金原子间最小间隙为apm(1pm=10-10cm)。则铜原子的半径为_______cm(写出计算表达式)。
【答案】 1 O、S、H 共价键、配位键、离子键 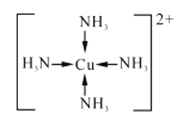 sp3杂化 氨分子间存在氢键 金属晶体 基态铁原子的价电子排布式为3d64s2,失去3个电子后核外电子呈半充满稳定状态,因此I4远大于I3 AuCu3(或Cu3Au)
sp3杂化 氨分子间存在氢键 金属晶体 基态铁原子的价电子排布式为3d64s2,失去3个电子后核外电子呈半充满稳定状态,因此I4远大于I3 AuCu3(或Cu3Au) ![]()
【解析】(1)Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,故Cu2+的外围电子排布式为3d9,所以有1个未成对电子;同一主族,自上而下元素电负性递减,电负性O>S,H元素与O、S元素化合时,H元素表现正化合价,所以H元素的电负性比O、S元素的小,故电负性O>S>H。
(2)①SO42-、NH3中是以共价键结合形成的,(Cu(NH3)4)2+和SO42-之间结合的是离子键,配合物中Cu2+和(NH3)4(4个氨分子)以配位键结合,故[Cu(NH3)4]SO4中化学键类型有:共价键、离子键、配位键;[Cu(NH3)4]2+中Cu2+和(NH3)4(4个氨分子)以配位键结合,所以结构简式为: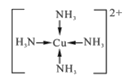 ;中心原子的孤对电子数=
;中心原子的孤对电子数=![]() (a-xb),公式中a为中心原子的价电子数,对于主族元素即为其中心原子的最外层电子数,x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数,H为1,其余为8-最外层电子数,硫酸根离子中,价层电子对数=σ键个数+
(a-xb),公式中a为中心原子的价电子数,对于主族元素即为其中心原子的最外层电子数,x为与中心原子结合的原子数,b为与中心原子结合的原子最多能接受的电子数,H为1,其余为8-最外层电子数,硫酸根离子中,价层电子对数=σ键个数+![]() (a-xb)=4+
(a-xb)=4+![]() (6+2-4×2)=4,所以采取sp3杂化。②氨分子间存在氢键,分子间作用力强,所以氨的沸点高于膦(PH3)。
(6+2-4×2)=4,所以采取sp3杂化。②氨分子间存在氢键,分子间作用力强,所以氨的沸点高于膦(PH3)。
(3)铁和铜属于金属,所以铁铜合金晶体是由金属键形成的晶体,属于金属晶体;因为基态铁原子的价电子排布式为3d64s2,根据洪特规则,原子轨道处于全充满、半充满或全空时,原子处于较低的能量状态,所以失去3个电子后核外电子呈半充满稳定状态,因此I4远大于I3。
(4)①根据均摊法计算,晶胞中金原子个数为8×![]() =1,铜原子的个数为6×
=1,铜原子的个数为6×![]() =3,则金和铜的原子个数比为1∶3,该合金的化学式为AuCu3(或Cu3Au)。②合金的密度为dg·cm-3,晶胞质量为:
=3,则金和铜的原子个数比为1∶3,该合金的化学式为AuCu3(或Cu3Au)。②合金的密度为dg·cm-3,晶胞质量为: ![]() g=
g=![]() g,设晶胞边长为a,则晶胞体积为a3,根据密度=质量÷体积,则a=
g,设晶胞边长为a,则晶胞体积为a3,根据密度=质量÷体积,则a=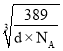 cm,该晶胞结构侧面可用如图表示:
cm,该晶胞结构侧面可用如图表示: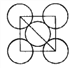 ,中间为铜原子,周围是金原子,晶胞边长是
,中间为铜原子,周围是金原子,晶胞边长是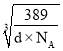 cm,两个金原子间最小间隙为apm(1pm=10-10cm),即a×10-10cm,则金原子半径为:
cm,两个金原子间最小间隙为apm(1pm=10-10cm),即a×10-10cm,则金原子半径为: ![]() (
( -a×10-10)cm,设铜原子半径为r,则在等腰直角三角形中:2(
-a×10-10)cm,设铜原子半径为r,则在等腰直角三角形中:2(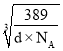 )2=[2r+2×
)2=[2r+2×![]() (
(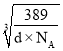 -a×10-10)]2,所以
-a×10-10)]2,所以![]() ×
×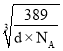 =2r+(
=2r+(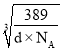 -a×10-10),解得r=(
-a×10-10),解得r=(![]() ×
×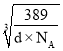 +5a×10-11)cm。
+5a×10-11)cm。


 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项中所示的物质间转化均能实现的是
A. NaOH(aq) ![]() Cu(OH)2悬浊液
Cu(OH)2悬浊液![]() Cu2O
Cu2O
B. NH3![]() NO
NO![]() HNO3
HNO3
C. MgC12(aq)![]() 无水MgC12
无水MgC12![]() Mg
Mg
D. CaCl2(aq)![]() CaCO3
CaCO3![]() CaO
CaO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)可用作纺织品漂白剂。过氧乙酸可通过下列方法制备: 向烧瓶中依次加入乙酸、42.5%过氧化氢溶液、浓硫酸。控制反应温度为25 ℃,搅拌4小时,静置15小时,得过氧乙酸溶液。
(1)制备20g38%过氧乙酸溶液至少需要42.5%过氧化氢溶液质量为________g。
(2)过氧乙酸含量测定。准确称取0.4900g过氧乙酸样液,定容于100 mL容量瓶中。取5.00 mL上述溶液于100 mL碘量瓶中,再加入5mL 2 mol·L-11H2SO4,用0.01 mol·L-1KMnO4溶液除去过氧乙酸样品中剩余H2O2,随即加入过量KI溶液,摇匀,用0.01 mol·L-1 Na2S2O3标准液滴定至终点,消耗Na2S2O3的体积为25.00 mL。
已知有关反应的方程式:CH3COOOH+2I-+2H+===I2+CH3COOH+H2O;2S2O32-+I2===2I-+S4O62-。
①加入过量KI溶液前,需KMnO4溶液除去H2O2的化学方程式为:______________________________。
②计算过氧乙酸样液中过氧乙酸的质量分数(给出计算过程并保留小数点后一位)__________。
③用该法测定过氧乙酸含量比实际含量偏高的原因是(不考虑实验操作产生的误差_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构简式如图(未表示出其空间构型).下列关于普伐他汀的描述正确的是( ) 
A.分子中含有3种官能团
B.可发生加成反应、氧化反应
C.在水溶液中羧基和羟基均能电离出H+
D.1mol该物质最多可与1mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用ClO2生产NaClO2并进行尾气处理的工艺如下:

(1) 写出“反应Ⅰ”中生成ClO2的化学方程式:______________________________。
(2) “尾气吸收”是为了吸收未反应的ClO2,除减少污染外,还能_________________。
(3) 实验室用下图所示装置模拟“尾气吸收”过程,发现温度较低时吸收效果好,但该反应为放热反应。在不改变吸收液浓度和体积的条件下,欲使反应在0 ℃~5 ℃下进行,实验中可采取的措施有__________、_____________。

(4) 为了测定获得产品中NaClO2的纯度,进行如下实验:
①准确称取1.000 g上述产品,溶于水配成100.00 mL的溶液。
②取10.00 mL待测液,加入过量的KI溶液,在酸性条件下发生如下反应:ClO+4I-+4H+===2H2O+2I2+Cl-,杂质不与I-反应。
③以______作指示剂,再加入0.2000 mol·L-1 Na2S2O3溶液,恰好完全反应时消耗Na2S2O3溶液的体积为20.00 mL。(已知:I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() )。计算该样品中NaClO2的纯度_____。
)。计算该样品中NaClO2的纯度_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如下图的实验装置中,实验开始一段时间后,对看到的现象叙述不正确的是 ( )

A.苹果块会干瘪 B.胆矾晶体表面有“白斑”
C.小试管内有KNO3晶体析出 D.pH试纸变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.用激光照射硫酸铜溶液可以观察到丁达尔现象
B.钠与氧气反应的产物与反应条件无关
C.燃着的镁条伸入盛满二氧化碳的集气瓶中不能继续燃烧
D.利用氯气单质的氧化性可以把碘离子转化为碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫的说法不正确的是()
A.试管内壁附着的硫可用二硫化碳溶解除去
B.游离态的硫存在于火山喷口附近或地壳的岩层里
C.单质硫既有氧化性,又有还原性
D.硫在空气中的燃烧产物是二氧化硫,在纯氧气中的燃烧产物是三氧化硫
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com