
【题目】根据元素周期表中短周期的下列内容回答问题:
H | ① | ||||||
② | ③ | O | ④ | ||||
⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(1)元素①~⑨形成的单质中,化学性质最稳定的是_____(填化学式)。④在元素周期表中的位置是________,⑥的简单离子的结构示意图为________________
(2)③、⑨和H元素可形成一种常见的盐,其中存在的化学键类型为________________,⑤、⑧按原子个数比2:1形成的化合物的电子式为________________
(3)写出一个可证明②和⑦非金属性强弱的离子方程式:________________
(4)在酸性溶液中,②的简单氢化物与O2组成燃料电池,其负极的电极反应式为________________
【答案】He 第二周期第ⅦA族 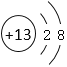 离子键、(极性)共价键
离子键、(极性)共价键 ![]() CO2+
CO2+![]() +H2O===
+H2O===![]() +H2SiO3↓或2CO2+
+H2SiO3↓或2CO2+![]() +2H2O===2
+2H2O===2![]() +H2SiO3↓ CH4-8e-+2H2O===CO2+8H+
+H2SiO3↓ CH4-8e-+2H2O===CO2+8H+
【解析】
由图可知,①为He,②为C,③为N,④为F,⑤为Na,⑥为Al,⑦为Si,⑧为S,⑨为Cl,据此解答。
(1)元素①~⑨形成的单质中,化学性质最稳定的是稀有气体He,④是F,在元素周期表中位于第二周期第ⅦA族,⑥是Al,13号元素,Al3+离子的结构示意图为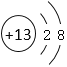 ,故本题答案为:He;第二周期第ⅦA族;
,故本题答案为:He;第二周期第ⅦA族;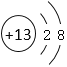 ;
;
(2)③为N、⑨为Cl,和H元素可形成一种常见的盐NH4Cl,属于离子化合物,且含有极性共价键,,⑤为Na、⑧为S,按原子个数比2:1形成的化合物是Na2S,电子式为![]() ,故本题答案为:离子键、(极性)共价键;
,故本题答案为:离子键、(极性)共价键;![]() ;
;
(3)②为C,⑦为Si,比较非金属性强弱可将二氧化碳通入硅酸钠溶液中,产生白色沉淀,即可证明碳酸酸性强于硅酸,通过最高价含氧酸的酸性强弱即可比较非金属性强弱,发生离子方程式CO2+![]() +H2O===
+H2O===![]() +H2SiO3↓或2CO2+
+H2SiO3↓或2CO2+![]() +2H2O===2
+2H2O===2![]() +H2SiO3↓,故本题答案为:CO2+
+H2SiO3↓,故本题答案为:CO2+![]() +H2O===
+H2O===![]() +H2SiO3↓或2CO2+
+H2SiO3↓或2CO2+![]() +2H2O===2
+2H2O===2![]() +H2SiO3↓;
+H2SiO3↓;
(4)②的简单氢化物为甲烷,与O2组成燃料电池,负极为甲失电子,在酸性条件下生产二氧化碳和氢离子,电极反应式为CH4-8e-+2H2O===CO2+8H+,故本题答案为:CH4-8e-+2H2O===CO2+8H+。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验。下列有关说法正确的是:

A. 根据上述步骤II可以得出m(Fe2O3)∶m(Cu)=1∶1
B. 步骤I中减少的3 g固体一定是混合物
C. 步骤II中质量减少的物质一定是Cu
D. 根据步骤I、II可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲基、苯基、羟基、羧基四种基团,在它们两两组合形成的化合物中:
(1)能使石蕊试液变色的是_______________(只需写出一种物质的结构简式,下同);
(2)能与溴水反应的是____________;
(3)催化氧化后产物能与新制氢氧化铜反应的是_________________;
(4)能与氯化铁溶液反应的是__________________________;
(5)不同情况下与氢氧化钠反应能生成两种盐的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于烃类物质的叙述正确的是( )
A.炔烃CH3—C≡C—CH2—CH3分子中所有的碳原子共直线
B.苯的同系物随着分子中碳原子数目的增加,碳元素的百分含量逐渐减小
C.所有的烯烃两两之间互为同系物
D.正戊烷分子中的碳链是直线型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如图所示(部分产物已略去):
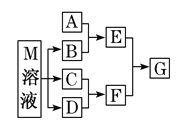
(1)写出B的电子式________。
(2)若A是一种常见的酸性氧化物,且可用于制造玻璃,写出A和B水溶液反应的离子方程式________。
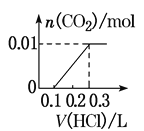
(3)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,生成的CO2物质的量与所用盐酸体积如图所示,则A与B溶液反应后溶液中溶质的化学式_____。
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是__________。
(5)若A是一种氮肥, A和B反应可生成气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式为_________。
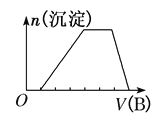
(6)若A是一种溶液,可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32- 、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子的物质的量浓度之比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A物质在一定条件下可转化为其它物质,已知A分子中所有碳原子不在同一条直线上,根据图示填空:
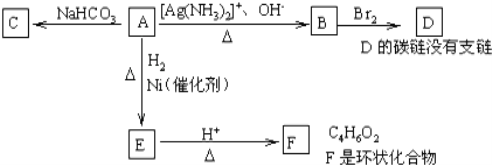
(1)化合物A含有的官能团名称是__。
(2)A转化为E的化学方程式是___。
(3)与A具有相同官能团的A的同分异构体的结构简式是__。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是__。
(5)F的结构简式是__,由E生成F的反应类型是__,由B生成D的反应类型是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子表所用的纽扣电池,两极材料为锌和氧化银,电解质溶液为KOH溶液,电池反应为 Ag2O + Zn + H2O═2Ag + Zn(OH)2,示意图如右。下列判断正确的是( )

A. 锌为负极,被还原
B. 纽扣电池工作时,OHˉ移向Ag2O
C. 每6.5 g 锌发生反应时,转移电子0.1 NA
D. 纽扣电池工作时,电解质溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是分离混合物时常用的仪器,可以进行的混合物分离操作分别是()
![]()
A.蒸馏、过滤、萃取、蒸发B.蒸馏、蒸发、萃取、过滤
C.萃取、过滤、蒸馏、蒸发D.过滤、蒸发、萃取、蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com