
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验。下列有关说法正确的是:

A. 根据上述步骤II可以得出m(Fe2O3)∶m(Cu)=1∶1
B. 步骤I中减少的3 g固体一定是混合物
C. 步骤II中质量减少的物质一定是Cu
D. 根据步骤I、II可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
【答案】A
【解析】
9.4gX与过量的氢氧化钠溶液反应后得到6.4g不溶物,固体部分溶解,原固体中至少含有Al2O3、SiO2的一种物质;6.4g固体与过量的盐酸反应得到蓝色溶液,蓝色溶液中存在铜离子,发生了反应:Fe2O3+6H+═2Fe3++3H2O;Cu+2Fe3+═2Fe2++Cu2+,说明溶液中一定存在Fe2O3,1.92g固体为铜。
A、设氧化铁的物质的量是x,金属铜的物质的量是y,由Fe2O3+6H+=2Fe3++3H2O、Cu+2Fe3+=2Fe2++Cu2+得出:Fe2O3~2Fe3+~Cu,则160x+64y=6.4,64y-64x=1.92,解得x=0.02mol,y=0.05mol,所以氧化铁的质量为0.02mol×160g·mol-1=3.2g,金属铜的质量为0.05mol×64g·mol-1=3.2g,则原混合物中m(Fe2O3):m(Cu)=1:1,故A正确。
B、步骤Ⅰ中,加入过量氢氧化钠溶液固体质量减少了3 g,溶解的物质可能是Al2O3和SiO2中的一种或两种,故B错误;
C、步骤Ⅱ中加入过量盐酸,Fe2O3溶解后又和Cu发生反应,故减少的固体是Fe2O3和Cu,故C错误;
D、根据步骤I只能判断混合物中至少含有Al2O3、SiO2的一种物质,无法确定Al2O3、SiO2是否都存在;步骤II可以确定一定存在Fe2O3、Cu,故D错误;
故选A。


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步反应直接完成的是
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物 X 可能是由 Na2SiO3、 Fe 、 Na2CO3、 BaCl2中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计实验方案如下图所示(所加试剂均过量)。下列说法不正确的是:

A. 该固体混合物一定含有 Fe、 Na2CO3、 BaCl2
B. 气体A一定是混合气体
C. 白色沉淀B在空气中逐渐变灰绿色,最后变红褐色
D. 沉淀A一定是 H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ亚铁氰化钾K4[Fe(CN)6],俗名黄血盐,可溶于水,不溶于乙醇。它是一种食品添加剂,我们所食用的部分食盐中就添加了亚铁氰化钾作为抗结剂。如果食用过量,易引起胃肠适。同学们可以观察一下家中食盐的配料表,尽量选用不含抗结剂的食盐。亚铁氰化钾可用如下方法进行制备。
已知HCN是一种极弱的酸,现有一种用含NaCN的废水合成黄血盐的主要工艺流程如下:
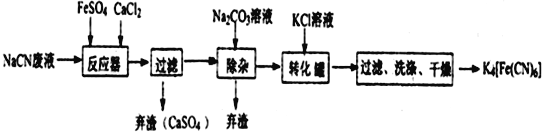
(1)常温下,NaCN水溶液的pH_______7(填“>”、“<”、“ = ”)。
(2)反应器中发生的主要反应的化学方程式为_____________________________。
(3)流程中加入Na2CO3溶液后过滤除去弃渣,过滤需要的玻璃仪器有烧杯、漏斗、______________。
(4)转化器中生成K4[Fe(CN)6]的反应类型是_______________,相同温度下,溶解度:K4[Fe(CN)6]___________Na4[Fe(CN)6](填“>”“ = ”“<”)。
(5)实验室常用K4[Fe(CN)6]检验Fe3+,生成难溶盐KFe[Fe(CN)6],试写出上述反应的离子方程式为_____________________________。
Ⅱ亚铁氰化钾也可以用硫酸亚铁铵为原料制备。可以用氧化还原滴定法测定晶体中Fe2+的含量。称取一份质量为20.0g 的硫酸亚铁铵晶体样品,制成溶液。用0.5 mol/L KMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO4- 被还原成Mn2+时,耗KMnO4 溶液体积20.00mL。
滴定时,将KMnO4 溶液装在____(酸式或碱式) 滴定管中,判断反应到达滴定终点的现象为__________ ;晶体中FeSO4的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素。回答下列问题:
(1)甲能形成多种常见单质,在熔点很高的两种常见单质中,原子的杂化方式分别为______、__________。
(2)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测丁元素的电离能突增应出现在第________电离能。
(3)戊的基态原子有________种形状不同的原子轨道;
(4)甲、乙分别都能与丙形成原子个数比为 1:3的微粒,则该两种微粒的空间构型分别为:_________________ ;__________________。
(5)丙和丁形成的一种离子化合物的晶胞结构如右图,该晶体中阳离子的配位数为_________ 。距一个阴离子周围最近的所有阳离子为顶点构成的几何体为_______________。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,该化合物的相对分子质量为 M,则该晶胞中黑球的半径r =_____cm。(用含ρ、NA的计算式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜矿石的主要成分是Cu2O,还含有少量的Al2O3、Fe2O3和SiO2。某工厂利用此矿石炼制精铜的工艺流程如图所示(已知:Cu2O+2H+=Cu+Cu2++H2O)。
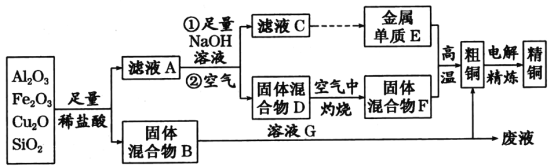
(1)滤液A中铁元素的存在形式为______________(填离子符号),生成该离子的离子方程式为____________________________________________________________________,
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为_____________,
在实验室中完成此实验还需要的试剂是________。
a.KClO3 b.KCl c.Mg d.MnO2
(3)溶液G与固体混合物B反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 氢氟酸贮存在细口玻璃瓶里
B. 盛溴的试剂瓶里加一些水来防止溴挥发
C. 可用滴加酚酞看其是否变红的方法来检测久置的烧碱是否变质
D. 氯水保存在无色玻璃瓶中;液氯存贮存在钢瓶里
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A. H+(aq)+OH-(aq)===H2O(l) ΔH=-a kJ· mol-1,故1 mol NaOH固体与足量的稀盐酸反应,放出热量为a kJ
B. 常温下,将10 mL pH=a的盐酸与100 mL pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13
C. 镀锌钢管破损后,负极反应式为Fe-2e-===Fe2+
D. 把碳酸氢钠溶液蒸干灼烧,最后得到的固体产物是碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的强酸性溶液中,能大量共存的离子组是
A.K+、Na+、NO3-、HCO3-B.K+,Cu2+、Na+、Cl-
C.Na+、Mg2+、NO3-、SO42-D.Ag+、Na+、Cl-、OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com