
【题目】草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO![]() +H2C2O4+H+→Mn2++CO2↑+H2O(未配平)用4mL0.001mol·L-1KMnO4溶液与2mL0.01mol·L-1H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响。改变的条件如表所示:
+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)用4mL0.001mol·L-1KMnO4溶液与2mL0.01mol·L-1H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响。改变的条件如表所示:
组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
Ⅰ | 2 | 20 | |
Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
Ⅲ | 2 | 30 | |
Ⅳ | 1 | 20 | 1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为________。
(2)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是_______;如果研究温度对化学反应速率的影响,使用实验Ⅰ和___________(Ⅰ~Ⅳ表示)。
(3)实验Ⅳ中加入1 mL蒸馏水的目的是_______________________________。
【答案】 2∶5 催化剂 Ⅲ 确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,实验Ⅳ中c(H+)不同。
【解析】(1)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O中,Mn元素的化合价降低,C元素的化合价升高,MnO4-为氧化剂,H2C2O4为还原剂,物质的量之比为2:5,故答案为:2:5;
(2)实验Ⅰ、Ⅱ温度、浓度相同,研究了催化剂对化学反应速率的影响;研究温度对化学反应速率的影响,应保证浓度、不使用催化剂相同,则选实验Ⅰ、Ⅲ,故答案为:催化剂;Ⅲ;
(3)实验Ⅰ和Ⅳ,硫酸的浓度不同,可研究浓度对反应速率的影响,加少量蒸馏水确保两实验中总体积相等,可使Ⅰ和Ⅳ中硫酸浓度不同,故答案为:确保所有实验中c(KMnO4)、c(H2C2O4)浓度不变和总体积不变,实验Ⅳ中c(H+)不同。


科目:高中化学 来源: 题型:
【题目】工业上常以铬铁矿(主要成分为亚铬酸亚铁FeCr2O4,还含有Al2O3、SiO2等杂质)为主要原料生产红矾钠(Na2Cr2O7),某实验小组模拟其流程如下图所示:
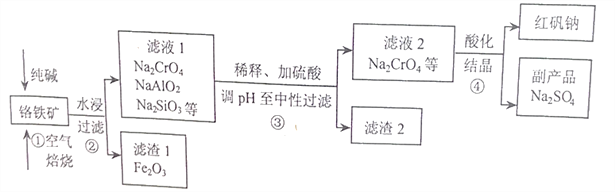
(1)FeCr2O4中Cr的化合价为____________,步骤①焙烧时所用的仪器名称为_________;步骤①中生成Na2CrO4的化学方程式为________________________。
(2)步骤①煅烧反应极慢,需要升温至纯碱呈熔融状态,反应速率才加快,其主要原因为________。
(3)步骤②过滤时所用到的玻璃仪器有________________;
(4)涉骤③用硫酸将溶液的pH调至中性,所得滤渣2的主要成分是__________、__________;
(5)步骤④向滤液2加入硫酸酸化过程中,溶液由黄色变为橙色,反应的离子方程式为___________。
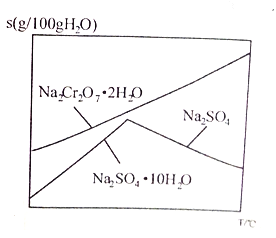
(6)下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,步骤④中获得副产品Na2SO4的实验操作方法为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按题给要求填空
(1)写出以乙炔为原料制备聚氯乙烯反应方程式(无机物不限)
① 。
② 。
(2)分子式为C6H12 的某烃的所有碳原子都在同一平面上,则该烃的结构简式为_________________,若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为___________________。
(3)1分子某烷烃含有50个电子,该烷烃只能由一种结构的炔烃加氢得到,则该烷烃的结构简式为 或 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( )
2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2
②用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2∶2∶1的状态
③混合气体的颜色不再改变的状态
④混合气体的密度不再改变的状态
⑤混合气体的平均摩尔质量不再改变的状态
⑥混合气体的压强不再改变的状态
A. ①②③④ B. ③④⑤⑥ C. ①③⑤⑥ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是:
A. 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化
B. Fe(OH)3胶体无色、透明,能发生丁达尔现象
C. 漂白粉、水煤气、氨水、胶体均为混合物
D. 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2L的恒温恒容密闭容器中充入2mol SO2和1mol O2,发生反应2SO2(g)+O2(g) ![]() 2SO3(g) △H=-Q kJ·mol-l (Q>O),下列有关说法不正确的是
2SO3(g) △H=-Q kJ·mol-l (Q>O),下列有关说法不正确的是
A. 反应达到平衡时,放出热量为QkJ
B. 若容器的压强不再发生交化,则反应达到平衡
C. 反应过程中c(SO2)+ c(SO3)=1 mol·L-1恒成立
D. 平衡时,SO2、O2的转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示的装置进行电解实验。A极是铜镍合金,B极为纯铜,电解质溶液为硫酸铜溶液(足量)。通电一段时间后,A极恰好全部溶解,此时B极质量增加3.2g,溶液质量增加0.05 g,(已知氧化性,Cu2+>Ni2+)则A合金中铜、镍原子个数比为

A.4∶1 B.3∶1 C.2∶1 D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为: ![]() 。有关该平衡体系的说法正确的是
。有关该平衡体系的说法正确的是
A.升高温度.平衡常数K一定增大
B.增大压强.W(g)质量分数增加
C.升高温度.若混合气体的平均相对分子质量变小.则正反应是放热反应
D.增大X(g)浓度.平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在未知液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体牛成,将气体通人澄清石灰水,石灰水变浑浊,由此判断水溶液中含有( )
A.Cl-,S042-
B.Cl-,NO3-
C.Cl-,CO32-
D.Cl-,OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com