
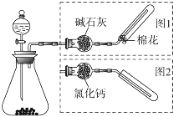
【题目】如图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示.下列选项中正确的是
选项 | 发生装置中的药品 | 干燥和集气装置 |
A | 电石和饱和食盐水 | 图2 |
B | 大理石和稀盐酸 | 图1 |
C | 铜和稀硝酸 | 图2 |
D | 氧化钙和浓氨水 | 图1 |
A.AB.BC.CD.D
【答案】D
【解析】
由实验装置可知,反应物为固体和液体,且不需要加热;图1收集装置的特点是:气体能用碱石灰干燥,气体可用向下排空气法收集;图2收集装置的特点是:气体能用氯化钙干燥,气体可用向上排空气法收集,结合发生的反应及气体的性质来解答。
A.电石和饱和食盐水可以制取C2H2,其密度比空气下,应用向下排空气法收集,故A错误;
B.大理石和稀盐酸反应生成二氧化碳,二氧化碳气体和碱石灰反应,所以不能用碱石灰干燥,但二氧化碳的密度大于空气的密度,应用向上排空气法收集,故B错误;
C.铜和稀硝酸反应生成NO,一氧化氮能和氧气反应生成二氧化氮,所以不能用排空气法收集,故C错误;
D.氧化钙和浓氨水反应生成氨气,氨气和碱石灰不反应,所以可用碱石灰干燥,氨气的密度小于空气的密度,所以可用向下排空气法收集,故D正确;
故选:D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A. y轴表示的可能是第一电离能
B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径
D. y轴表示的可能是原子形成简单离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蔗糖与浓硫酸反应的实验改进装置如图所示,下列说法错误的是
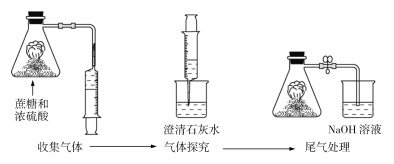
A.改进装置后,有毒气体被碱液吸收,实现了绿色环保
B.浓硫酸在实验过程中体现了脱水性和强氧化性
C.产生的气体能使澄清石灰水变浑浊,说明产生了CO2
D.该反应比较剧烈、危险,实验各物质的用量应按要求规范操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知阿伏加德罗常数的值为NA,根据所学知识填空。
(1)3molH2O含有__个H2O;
(2)含0.4molAl3+的Al2(SO4)3中所含的SO42-的质量是__g;
(3)已知NH3的相对分子质量为17,则NH3的摩尔质量为__g/mol;
(4)若某原子的摩尔质量为Mg·mol-1,则一个该原子的真实质量是___g;
(5)CO2中含有6.02×1023个O,则CO2的物质的量为__mol;
(6)6.02×1022个OH-的电子物质的量为___mol。
(7)已知一个铁原子的质量为bg,则铁的摩尔质量为___g/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于48。X的一种1∶1型氢化物分子中既有σ键又有π键。Z是金属元素,Z的单质和化合物广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。M有显著的“压电性能”,应用于超声波的发生装置。经X射线分析,M晶体的最小重复单元为正方体(如图),边长为4.03×10-10 m,顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。
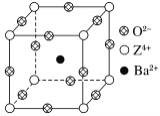
(1) Y在周期表中位于______________;Z4+的核外电子排布式为___________________。
(2)X的该种氢化物分子构型为________,X在该氢化物中以_______方式杂化。X和Y形成的化合物的熔点应该_______(填“高于”或“低于”)X氢化物的熔点。
(3)①制备M的化学方程式是_____________。
②在M晶体中,若将Z4+置于正方体的体心,Ba2+置于正方体的顶点,则O2-处于正方体的________。
③在M晶体中,Z4+的氧配位数为________。
④已知O2-半径为1.40×10-10 m,则Z4+半径为____ m。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】李克强总理在《2018年国务院政府工作报告》中强调“今年二氧化硫、氮氧化物排放量要下降3%。”研究烟气的脱硝(除NOx)、脱硫(除SO2)有着积极的环保意义。
Ⅰ. 汽车排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。
2CO2(g)+N2(g) ΔH=-746.50kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2L的密闭容器中,若温度和体积不变,反应过程中(0~15min) NO的物质的量随时间变化如图。
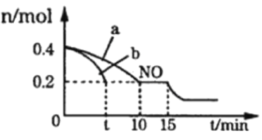
(1)图中a、b分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (NO)的变化曲线,其中表示催化剂表面积较大的曲线是______(填“a”或“b”)
(2)在a曲线所示反应中,0~10min内,CO的平均反应速率v(CO)=___________;T℃时,该反应的化学平衡常数K=_____________;平衡时若保持温度不变,再向容器中充入CO、CO2各0.2 mol,则平衡将_________移动(填“向左”、“向右”或“不”)
(3)15min时, n (NO)发生图中所示变化,则改变的条件可能是_______(填序号)
A.充入少量CO B.将N2液化移出体系 C.升高温度 D.加入催化剂
Ⅱ. 已知有下列反应:
①5O2(g)+ 4NH3(g)![]() 6H2O(g)+ 4NO(g) △H1
6H2O(g)+ 4NO(g) △H1
②N2(g)+O2(g)![]() 2NO(g) △H2
2NO(g) △H2
③2NO(g)+ O2(g)![]() 2NO2(g) △H3
2NO2(g) △H3
(1)若在高效催化剂作用下可发生8NH3(g)+ 6NO2(g)![]() 7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=__________(用△H1,△H2,△H3表示),△S______0
7N2(g)+ 12H2O(g)的反应,对NO2进行处理则该反应的△H=__________(用△H1,△H2,△H3表示),△S______0
(2)某温度下,向某恒容密闭容器中充入一定量的NH3和NO2,按照(1)的原理模拟污染物的处理。若容器中观察到________________(填序号),可判断该反应达到平衡状态
A.混合气体颜色不再改变 B. 混合气体的密度不再改变
C.混合气体摩尔质量不再改变 D. NH3和NO2的物质的量之比不再改变
(3)将一定比例的O2、NH3和NO2的混合气体,匀速通入图(a)所示装有催化剂M的反应器中充分进行反应。
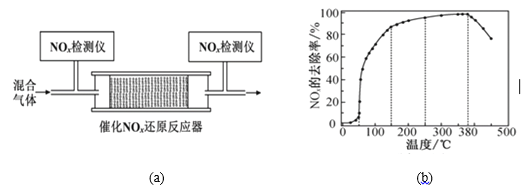
反应相同时间NOx的去除率随反应温度的变化曲线如图(b)所示。已知该催化剂在100~150℃时活性最高,那么在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢,其中去除率迅速上升段的主要原因是____________________________;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、X、Y、B、C、D、E、M是前30号元素,原子序数依次增加。A原子是周期表中半径最小的原子;X的基态原子次外层有2个电子,最外层有3个未成对电子;Y原子的2p轨道上有1个电子的自旋方向与其它电子相反;B的价层电子排布式为ns1,C和Y形成的化合物是引起酸雨的主要大气污染物,常温下,D的单质是一种黄绿色的气体;E的+3价离子的3d轨道为半充满状态,M与E元素位于同一周期,且为ⅠB族元素。
(1)B、Y、C分别形成的简单离子的半径由大到小顺序为(填离子符号)_________
(2)元素D基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是______(写元素符号)。
(3)M与D形成的一种化合物的立方晶胞如图所示。
①该化合物的化学式为_______
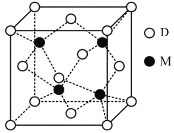
②此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______,其中配位体为_______分子(填“极性”或“非极性”),
(4)基态C原子电子占据最高能级的电子云轮廓图为_______形。将A2C通入ED3溶液中反应的离子方程式为_______
(5)用200mL1mol·L-1的BYA溶液吸收4.48L(标准状况)CY2所得溶液的pH<7,溶液中离子浓度由大到小的顺序为___________________________。
(6)工业上用电化学法治理酸性废液中XY3的原理如图,阴极的电极反应式为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知铜在常温下能被稀HNO3溶解。反应方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO ↑+4H2O
(1)请将上述反应改成离子方程式____。
(2)用双线桥法表示电子得失的方向和数目:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O。___
(3若生成896mL的NO(标准状况下),则该过程中转移的电子数目是___。
(4)氧化剂与氧化产物的物质的量比为___。
Ⅱ.某反应体系有反应物和生成物共7种物质:C、H2SO4、K2CrO4、K2SO4、CO2、Cr2(SO4)3和H2O。已知该反应中发生如下过程:C→CO2。该反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数,下列说法正确的是( )
A.18g H2O与18g D2O所含电子数均为10NA
B.32g硫在足量的纯氧中充分燃烧,转移电子数为3NA
C.常温常压下,6.4g O2和O3的混合气体中氧原子数为0.4NA
D.22.4L CO2和SO2和混合气体中原子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com