
【题目】用固体NaOH配制物质的量浓度溶液时,下列操作会导致溶液浓度偏低的是:
A. 在烧杯中溶解时,有少量液体溅出
B. 样品中含有少量Na2O杂质
C. 容量瓶使用前用NaOH溶液润洗
D. 定容时俯视容量瓶刻度线
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境.某化学实验小组进行如下有关SO2性质的探究活动. 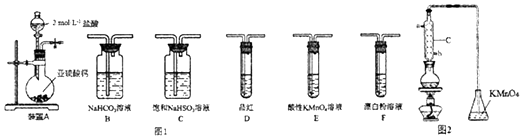
(1)装置A中反应的离子方程式为 .
(2)选用图1以上装置和药品探究亚硫酸与次氯酸的酸性强弱;
①甲同学认为按照A→C→F→尾气处理顺序连接装置可以证明亚硫酸和次氛酸的酸性强弱,乙同学认为该方案不合理,其理由是 .
②丙同学设计的合理实脸方案为:按照A→C→尾气处理(填字母)顺序连接装置.其中装置C的作用是 . 证明亚硫酸的酸性强于次氯酸的酸性的实验现象是 .
(3)利用如图2 的装置A测残液中SO2的含量.量取10.00mL残液于圆底烧瓶中,加热使SO2全部蒸出,用20.00mL 0.1000mol/L的KMnO4标准溶液吸收.充分反应后,再用0.200Omol/L的KI溶液滴定过量的KMnO4 , 消耗KI溶液25.00mL.
(己知:5SO2+2MnO4﹣+2H2O=2Mn2++5SO42﹣+4H+ , 10I﹣+2MnO4﹣+16H+=2Mn2++5I2+8H2O)
①该装置中仪器C的名称为 , 水通入C的进口为 .
②残液中SO2的含量为mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C分两步进 行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能.下列有 关叙述正确的是( ) 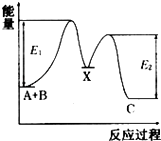
A.E2表示反应X→C的活化能
B.X是反应A十B→C的催化剂
C.反应A十B→C的△H<0
D.加入催化剂可改变反应A十B→C的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:2FeSO4![]() Fe2O3+ SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验:
Fe2O3+ SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验:
(1)取少量分解得到的固体加入稀盐酸溶解,为检验溶液中是否有Fe3+,下列试剂或药品中最合适的是 (填序号),加入该试剂后可观察的现象为 。
A.稀盐酸 B.氯气 C.KSCN溶液 D.氯化铜溶液
(2)将高温分解产生的气体通入下图所示装置中,以检验产生的气体成分。
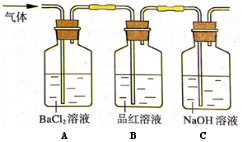
请回答下列问题:
①若在装置A中,观察到有白色沉淀生成,则该沉淀为 ,表明有 气体存在。
②装置C中的NaOH溶液的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质有如下相互转化关系(其中X、W为单质,Y、Z为化合物,未列出反应条件)。

(1)若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则X单质在常温下的颜色为 。
(2)若X是常温下密度最小的气体,Y由两种非金属元素组成,其中一种在地壳中的含量仅次于氧,另一种在海水中的含量仅次于氢和氧,则Z的化学式为 。
(3)若X原子的质子数是W原子质子数的2倍,且X原子最外层电子数为2。则W的原子结构示意图为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置制取ClO2 , 并以ClO2为原料制备亚氯酸钠(NaClO2是一种高效氧化剂、漂白剂).已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2 , 高于60℃时NaClO2分解成NaClO3和NaCl. 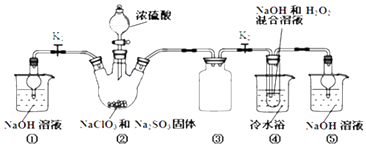
完成下列填空:
(1)装置②中产生ClO2的化学方程式为;装置④中发生反应的离子方程式为 .
(2)装置③的作用是;装置①和⑤在本实验中的作用 .
(3)装置④反应后的溶液中还含有少量NaOH杂质,从该溶液获得无水NaClO2晶体的操作步骤为:①减压,55℃左右蒸发结晶;②趁热过滤;③用50℃左右的温水洗涤;④低于60℃干燥,得到成品.步骤③中用50℃左右的温水洗涤的原因是 .
(4)亚氯酸钠纯度测定:①准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应.将所得混合液配成250mL待测溶液.②取25.00mL待测液,用2.0 molL﹣1Na2S2O3标准液滴定(I2+2S2O32﹣=2I﹣+S4O62﹣),以淀粉溶液做指示剂,达到滴定终点时的现象为 . 重复滴定3次,测得数据如表所示,则该样品中NaClO2的质量分数为 .
实验序号 | 滴定前读数/mL | 滴定后读数/mL |
1 | 0.00 | 19.96 |
2 | 3.26 | 23.30 |
3 | 1.10 | 23.40 |
(5)实验过程中若NaClO2变质可分解为NaClO3和NaCl.取等质量NaClO2 , 其中一份加热高于60℃使之变质,另一份严格保存,均配成溶液,并分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量(填“相同”“不相同”或“无法判断”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为从海带中提取碘的工业生产过程,有关说法错误的是

A.因海水中蕴藏着极其丰富的碘元素,所以工业上也可以直接用海水来提取碘元素
B.碱化操作时,加入NaOH溶液的原因是在碱性溶液中,可溶性有机质可形成沉淀
C.在实验室进行氧化操作时,加入的氧化剂可以是新制氯水、双氧水等
D.在实验室进行过滤操作时,需要用到玻璃仪器有玻璃棒、烧杯、漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性强弱:Br<Fe2+。往100ml溴化亚铁溶液中缓慢通入2.24 L(标准状况)氯气,反应完成后溶液中有1/2的Br被氧化成Br2。则原溴化亚铁溶液的物质的量浓度为
A. 1.0mol/L B. 1.5mol/L C. 1.1mol/L D. 1.2mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com