
【题目】在容积不变的容器中加入一定量的A和B,发生反应∶2A(g)+B(g)![]() 2C(g), 在相同时间内,测得不同温度下A的转化率如下表所示,下列说法正确的是
2C(g), 在相同时间内,测得不同温度下A的转化率如下表所示,下列说法正确的是
温度/°C | 100 | 200 | 300 | 400 | 500 |
转化率 | 30% | 75% | 75% | 50% | 18% |
A.该反应随着温度升高,反应速率先变大后变小
B.200°C,A的转化率为75%时,反应达到平衡状态
C.当单位时间内生成n mol B的同时消耗2n molC时,反应达到平衡状态
D.400°C时,B的平衡浓度为0.5 mol/L,则该反应的平衡常数K=2
【答案】D
【解析】
A.升高温度,化学反应速率增大,故该反应随着温度升高,反应速率增大,选项A错误;
B.根据表中数据可知,300°C反应物A的转化率降低,证明反应为放热反应,长高温度平衡逆向移动,无法说明200°C,A的转化率为75%时,反应就一定达到平衡状态,选项B错误;
C.当单位时间内生成n mol B的同时消耗2n molC时,不能说明正逆反应速率相等,反应不一定达到平衡状态,选项C错误;
D.400°C时,A的转化率为50%,根据反应2A(g)+B(g)![]() 2C可知,平衡时c(A)=c(C),B的平衡浓度为0.5 mol/L,则该反应的平衡常数K=
2C可知,平衡时c(A)=c(C),B的平衡浓度为0.5 mol/L,则该反应的平衡常数K=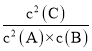 =
=![]() =
=![]() =2L/mol,选项D正确。
=2L/mol,选项D正确。
答案选D。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列操作或装置,不能达到实验目的的是( )。

A.图Ⅰ用于实验室制氨气并收集干燥的氨气
B.图Ⅱ用于检验浓硫酸与铜反应后的产物中是否含有铜离子
C.图Ⅲ用于验证牺牲阳极的阴极保护法
D.图Ⅳ用于制取![]() 晶体
晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)阅读、分析下列两个材料:
材料一
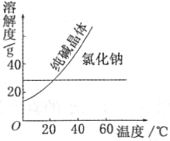
材料二
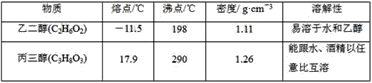
回答下列问题(填字母):
A.蒸馏法
B.萃取法
C.“溶解、结晶、过滤”的方法
D.分液法
①将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用___;
②将乙二醇和丙三醇相互分离的最佳方法是___。
(2)阅读材料三回答下列问题:
材料三
在溶解性方面,Br2(溴)与I2(碘)很相似,其稀的水溶液显黄色。在实验室里从溴水(Br2的水溶液)中提取Br2和提取I2的方法相似。
①常用的提取方法是___,化学试剂是___,最主要的仪器是___。
②若观察发现提取Br2以后的水还有颜色,解决该问题的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | α1 (SO2) | α2 (SO3) | α3 (SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v/span>1<v2,c2< 2c1 B. K1>K3,p2> 2p3
C. v1<v3,α1(SO2) <α3(SO2) D. c2> 2c3,α2(SO3)+α3(SO2)<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于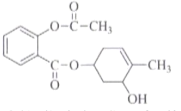 的说法,不正确的是
的说法,不正确的是
A.该物质能发生加成、氧化、聚合等反应
B.该物质苯环上的一氯取代有4种同分异构体
C.该物质在酸性条件下水解产物之一可用于合成阿司匹林
D.1mol该物质与足量NaOH溶液反应,最多可消耗5molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体,图 1 表示各物质浓度随时间的变化,图 2 表示速率随时间的变化,t2、t3、t4、t5 时刻各改变一种条件,且改变的条件均不同。若t4时刻 改变的条件是压强,则下列说法错误的是

A.若 t1=15 s,则前 15 s 的平均反应速率 v(C)=0.004 mol·L-1·s-1
B.该反应的化学方程式为 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D.若 t1=15 s,则 B 的起始物质的量为 0.04 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的实验步骤:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4Cl晶体析出。……
请回答下列问题(提示B分液漏斗中为浓氨水,滴入烧瓶可产生氨气):
(1)装置的连接顺序是:(a)接________,________接________;(b)接________

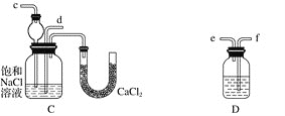
(2)A中常选用的固体反应物为______________;D中应选用的液体为________________(填化学式)。
(3)第二步骤中必须先让__________装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是______________________________,C中广口瓶内产生固体的总化学方程式为______________________ 。
(5)在第四步中分离NH4Cl晶体的操作是____________________(填操作名称);其所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验证明所得固体的成分中含有Na+,简要写出操作和现象____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2 p1>p2 m+n>p 放热反应B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R均为主族元素,已知M的一个原子失去2个电子,R的一个原子得到1个电子后形成稀有气体元素的电子层结构。下列关于M与R形成的化合物的叙述正确的是( )
A. M与R可以形成MR2型离子化合物
B. 在MR2中M的离子半径比R的离子半径大
C. 形成的两种离子分别是M+和R2-
D. MR2的电子式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com