
【题目】NA为阿伏加德罗常数,下列叙述中正确的是
①106 g Na2CO3晶体中的离子总数大于3NA
②25 ℃、1.01×105 Pa下,14 g氮气所含的氮原子数为NA
③标准状况下,22.4LCCl4中所含的分子数约为6.02×1023
④标准状况下,aL的氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023
×6.02×1023
⑤常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
A.①②④B.②④⑤C.③④⑤D.④⑤
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】某课外研究性学习小组拟用粗盐(含有少量杂质包括:泥沙、CaCl2、MgCl2、Na2SO4)经提纯后,配制0.4mol/L 450mL NaCl溶液.他们设计并实施了如下实验,请根据已学过的知识回答下列问题:
(1)取一定量的粗盐置于烧杯中加适量的水溶解。将配制的粗盐悬浊液过滤后取滤液加入过量的除杂试剂,如果除杂试剂可从下列六种溶液中选择①Na2CO3溶液②KOH溶液③AgNO3溶液④NaOH溶液⑤NaHCO3溶液⑥BaCl2溶液,则正确的试剂和加入的顺序应为:__________(填选项)
A.①②③ B.②⑥⑤ C.④⑥① D.①④⑥ E.⑥①④ F.⑥②⑤
(2)将所得的悬浊液经过滤后取滤液加入足量的盐酸,充分反应后对混合溶液进行蒸发、过滤、洗涤、干燥操作,得到纯净的NaCl固体,请描述在蒸发操作过程中玻璃棒的作用:_______________________________________________________
(3)利用(2)中所得的NaCl固体继续配制所需溶液.在托盘天平上称量____g NaCl固体.配制过程中需要使用的玻璃仪器有:烧杯、玻璃棒、_________
和_______________
(4)配制结束后同学们对实验中出现的某些错误操作,对最终配制的溶液浓度的影响进行了分析,则下列错误操作会导致最终配制溶液中NaCl的浓度相比0.4mol/L是偏小的是__________
A.在上述(2)步中没有使用盐酸处理滤液;
B.在上述(3)步中没有对烧杯和玻璃棒进行洗涤;
C.定容时俯视凹液面;
D.上下颠倒摇匀后液面低于刻度线,未及时加水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命。它的分子式为C15H22O5,关于青蒿素的说法正确的是( )
A.2.82g青蒿素含氧原子数目为0.05NA
B.标准状况下,1 mol青蒿素的体积为22.4 L
C.青蒿素含氧的质量分数为10%
D.青蒿素的摩尔质量为282
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用规范的化学用语回答下列问题
(1)下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

①从氯化钾溶液中得到氯化钾固体,选择装置__________ (填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置_________,为检测Cl-杂质是否除干净,应进行的操作_________________________________
②从碘水中分离出I2的方法,名称为________________________。
③装置A中①的名称是________,进水的方向是从______(填“上”“下”)口进水,装置B在分液时为使液体顺利下滴,应进行的具体操作是_______________________。
(2)实验室配制Fe(OH)3胶体时,将饱和的FeCl3溶液滴入沸水中,并继续加热至溶液呈红褐色,停止加热。向所得胶体中逐滴加入稀硫酸,开始观察到的现象是__________,这种现象称为胶体的________;最后观察到的现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式____________________。
(2)下列三种情况下,离子方程式与(1)相同的是_____(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度![]() 表示)可近似地用图中的_____曲线表示(填序号)。
表示)可近似地用图中的_____曲线表示(填序号)。
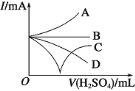
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将_____(选填“上浮”、“不动”、“下降”)。
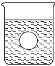
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】颠茄酸酯(H)有解除胃肠道痉挛、抑制胃酸分泌作用,常用于胃肠道平滑肌痉挛及溃疡病的辅助治疗,其合成路线如下:
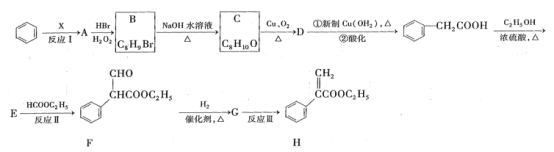
试回答下列问题:
(1)反应I所涉及的物质均为烃,氢的质量分数均为7.69%,A的相对分子量小于110,则A分子中最多有_______个碳原子在一条直线上。
(2)B的结构简式是_________________________。
(3)F中含有的官能团名称是____________________________。
(4)由C→D反应的化学方程式为___________________________________________。
(5)化合物G有多种同分异构体,同时满足下列条件的有________________种。
①能发生水解反应和银镜反应; ②能与FeCl3发生显色反应;
③苯环上有四个取代基,且苯环上一氯代物只有一种。
(6)参照上述合成路线,设计由 ![]() 制备
制备 ![]() 的合成路线为:___________
的合成路线为:___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用环己醇脱水的方法合成环己烯,该实验的装置如下图所示:

可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
按下列实验步骤回答问题:
Ⅰ.产物合成
在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(l)碎瓷片的作用是________;b的名称是________;
(2)a中发生主要反应的化学方程式为____________________________;本实验最容易产生的有机副产物的结构简式为________。
Ⅱ.分离提纯
将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加人无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为4.1g。
(3)用碳酸钠溶液洗涤的作用是________,操作X的名称为________。
Ⅲ.产物分析及产率计算
(4)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有_______种不同化学环境的氢原子。
② 本实验所得环己烯的产率是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全气囊逐渐成为汽车的标配,因为汽车发生剧烈碰撞时,安全气囊中迅速发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑,产生大量的气体使气囊迅速弹出,保障驾乘车人员安全。下列关于该反应的说法正确的是
A.该反应中NaN3是氧化剂,KNO3是还原剂
B.氧化产物与还原产物的物质的量之比为1∶15
C.若有50.5 g KNO3参加反应,则有0.5mol N原子被还原
D.每转移1 mol e,可生成标准状况下N2的体积为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,近年来发现了一种新的星际分子,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子)。
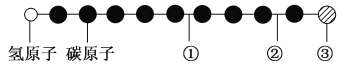
下列对该物质的说法中正确的是
A. ①处的化学键表示碳碳双键 B. ②处的化学键表示碳碳单键
C. ③处的原子可能是氯原子或氟原子 D. 此星际分子属于烃类
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com