
【题目】下列方程式书写正确的是( )
A.NaHSO4在水溶液中的电离方程式:NaHSO4=Na++HSO4-
B.H2SO3的电离方程式:H2SO3![]() 2H++SO32-
2H++SO32-
C.CO32-的水解方程式:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
D.CaCO3的电离方程式:CaCO3![]() Ca2++CO32-
Ca2++CO32-
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】参考下列图表和有关要求回答问题:
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___(填“增大”“减小”或“不变”,下同),ΔH的变化是__。请写出NO2和CO反应的热化学方程式:__。

(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:___。
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | a | b | c | x |
已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=___kJ·mol-1(用含有a、b、c、d的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学实验![]() 观察现象
观察现象![]() 分析推理一得出结论”是化学学习的方法之一,下列说法正确的是
分析推理一得出结论”是化学学习的方法之一,下列说法正确的是![]()
A.检验氯化铁溶液中是否有氯化亚铁,可取待测液加入酸性高锰酸钾溶液中,若酸性高锰酸钾溶液褪色,则证明一定有氯化亚铁
B.将![]() 通入足量稀
通入足量稀![]() 溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,假设通入的
溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,假设通入的![]() 完全反应,则同温同压下,逸出的气体和通入的
完全反应,则同温同压下,逸出的气体和通入的![]() 的体积比为2:3
的体积比为2:3
C.验证淀粉的水解产物是否具有还原性,取水解液于试管中并加入新制氢氧化铜悬浊液,加热煮沸,观察是否出现砖红色沉淀
D.向铝质容器中加入食盐溶液,再将变黑的银器浸人该溶液中,一段时后发现黑色褪去,该过程中发生的反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各情况,在其中Fe片腐蚀由慢到快的顺序是
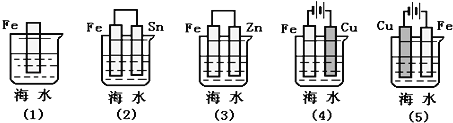
A.(5)(2)(1)(3)(4) B.(5)(1)(2)(4)(3)
C.(4)(2)(1)(3)(5) D.(4)(3)(1)(2)(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列现象或事实的解释正确的是![]()
选项 | 现象或事实 | 解释 |
A | 用热的纯碱溶液洗去油污 |
|
B | 漂白粉在空气中久置变质 | 漂白粉中的 |
C | 施肥时,草木灰 |
|
D | 钢铁在潮湿的空气中容易生锈 | 钢铁在空气中发生了析氢腐蚀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产和生活中有着广泛的应用。
I.氧化铁是重要工业颜料,用废铁屑制备它的流程如图:
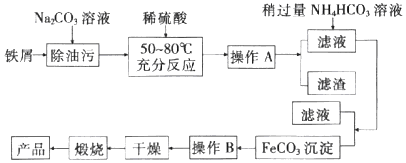
回答下列问题:
![]() 操作A、B的名称分别是______、______;加入稍过量的
操作A、B的名称分别是______、______;加入稍过量的![]() 溶液的作用是______。
溶液的作用是______。
![]() 写出在空气中充分加热煅烧
写出在空气中充分加热煅烧![]() 的化学方程式:______。
的化学方程式:______。
![]() 上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中
上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中![]() 的含量,进行如下实验:
的含量,进行如下实验:
![]() 称取样品
称取样品![]() ,加入足量稀
,加入足量稀![]() 溶解,并加水稀释至100mL;
溶解,并加水稀释至100mL;
![]() 量取
量取![]() 待测溶液于锥形瓶中;
待测溶液于锥形瓶中;
![]() 用酸化的
用酸化的![]() 标准液滴定至终点;
标准液滴定至终点;
![]() 重复操作b、
重复操作b、![]() 次,得出消耗
次,得出消耗![]() 溶液体积的平均值为
溶液体积的平均值为![]() 。
。
![]() 写出滴定过程中发生反应的离子方程式:______。
写出滴定过程中发生反应的离子方程式:______。
![]() 确定滴定达到终点的操作及现象为______。
确定滴定达到终点的操作及现象为______。
![]() 上述样品的质量分数为______。
上述样品的质量分数为______。
![]() 下列操作会导致样品中
下列操作会导致样品中![]() 的质量分数测定结果偏低的有______。
的质量分数测定结果偏低的有______。
![]() 未干燥锥形瓶
未干燥锥形瓶 ![]() 盛装标准液的滴定管没有用标准液润洗
盛装标准液的滴定管没有用标准液润洗
![]() 滴定结束时仰视刻度线读数
滴定结束时仰视刻度线读数![]() 量取待测液的滴定管没有润洗
量取待测液的滴定管没有润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修2:化学与技术]海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河人海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和________池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜 只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用_______(写一点即可)。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。
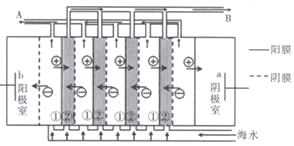
①海水不能直接通入到阴极室中,理由是______________.
②A口排出的是_______(填“淡水”或“浓水”)。
(3)用苦卤(含 Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:
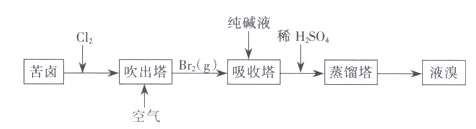
①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为___________。
②通过苦卤中通入Cl2已获得含溴的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液________。
③向蒸馏塔中通入水蒸气加热,控制温度在90![]() 左右进行蒸馏的原因是___________。
左右进行蒸馏的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO![]() 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
A.该温度高于25℃B.NaHSO4晶体的加入抑制了水的电离
C.由水电离出来的H+的浓度是1.0×10-10mol·L-1D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积常数 | 1×10-14 | α | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则α____(填“<”“>”或“=”)1×10-14,作出此判断的理由是___________________。
(2)25 ℃下,某Na2SO4溶液中c(![]() )=5×10-4mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
)=5×10-4mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
(3)t2 ℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________。此溶液中各种离子的浓度由大到小的排列顺序是_____________________。
(4)相同温度下等物质的量浓度的下列溶液中,
A、NH4Cl B、NH4HCO3 (溶液呈碱性) C、NH4HSO4 D、(NH4)2SO4
NH4+离子浓度由大到小的顺序是_______________(用对应的字母填写)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com