
【题目】常温下,下列物质中易与H2O反应生成氢氧化物的是
A.Fe2O3B.Al2O3
C.Na2OD.CuO
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室需要0.2mol·L-1 NaOH溶液480mL和0.5mol·L-1硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是__________(填序号),配制上述溶液还需用到的玻璃仪器是__________(填仪器名称)。

(2)下列有关容量瓶使用方法的操作中,错误的是__________
A.使用容量瓶之前应检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.定容时,将蒸馏水小心倒入容量瓶中直至与刻度线齐平
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复上下颠倒,摇匀
(3)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为__________g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度__________(填“>”“<”或“=”)0.2mol·L-1;
③若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度__________(填“>”“<”或“=”)0.2mol·L-1。
(4)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84g·cm-3的浓硫酸的体积为__________(计算结果保留一位小数)mL;
② 配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NaCl、MgCl2和MgSO4三种盐配成的混合溶液中,若Na+的浓度为0.1 mol/L,Mg2+的浓度为0.25 mol/L,Cl-的浓度为0.2 mol/L, 则SO42-的物质的量浓度为( )
A.0.5 mol/LB.0.2 mol/L
C.0.45 mol/LD.0.25 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C的原子序数逐渐增大,它们形成的离子具有相同的电子层结构,B和C的单质都能跟水剧烈反应,1 mol B单质跟水反应时,在标准状况下放出11.2 L A的气态单质,0.5 mol C单质跟水反应时,在标准状况下放出5.6 L H2,此时C转化成具有氖原子核外电子层结构的离子。问:
(1)写出A、B、C各元素的名称_____________。
(2)用电子式表示AC形成的一种淡黄色化合物_____________。
(3)用电子式表示BC形成化合物的过程_____________。
(4)用电子式表示A的简单氢化物的形成过程_____________。并解释沸点反常高的原因_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫是造成大气污染的主要有害气体之一,二氧化硫尾气处理的方法之一是采用钠一钙联合处理法。
第一步:用NaOH溶液吸收SO2。2NaOH+SO2=Na2SO3+H2O
第二步:将所得的Na2SO3溶液与生石灰反应。Na2SO3+CaO+H2O=CaSO3↓+2NaOH
完成下列填空:
(1)在上述两步反应所涉及的短周期元素中,原子半径由小到大的顺序是_______(用元素符号填写)。
(2)氧和硫属于同族元素,写出一个能比较氧元素和硫元素非金属性强弱的化学反应方程式:_______________________________________。
(3)NaOH的电子式为______________ 。
(4)若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的化学方程式______________。
(5)钠一钙联合处理法的优点有________________。(任写一点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_____与盐酸反应最剧烈;______与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_______________________________________________________。
(3)写出次氯酸的电子式____________。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
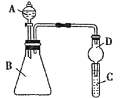
(1)仪器D的作用为_________________________________________。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,C中加淀粉碘化钾混合溶液,观察到C中溶液_______(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,用离子方程式表示该尾气吸收原理______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com