
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_____与盐酸反应最剧烈;______与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_______________________________________________________。
(3)写出次氯酸的电子式____________。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
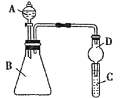
(1)仪器D的作用为_________________________________________。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,C中加淀粉碘化钾混合溶液,观察到C中溶液_______(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,用离子方程式表示该尾气吸收原理______________________________________________。
【答案】K Al S2- +Cl2=S↓+2Cl- 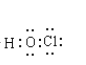 防止倒吸 变蓝 Cl2+2OH- = Cl- + ClO- +H2O
防止倒吸 变蓝 Cl2+2OH- = Cl- + ClO- +H2O
【解析】
I.(1)根据金属活动性顺序表可以判断钠、钾、镁、铝的活泼性,活泼性越强,与盐酸反应越剧烈;根据电子守恒比较生成氢气体积大小;
(2)硫离子被氯气氧化成硫单质,据此写出反应的离子方程式;
(3)HClO是共价化合物,氧原子分别和H原子、Cl原子各形成一个共用电子对;
II.(1)尾气处理装置中,有缓冲装置的能防止倒吸;
(2)浓盐酸和酸性高锰酸钾溶液发生氧化还原反应生成Cl2,Cl2具有氧化性,能氧化I-生成I2,碘遇淀粉试液变蓝色;Cl2和碱反应生成盐,可以用NaOH吸收氯气的尾气,反应生成NaCl和NaClO。
I.(1)金属活泼性顺序为:钾>钠>镁>铝,所以相同条件下与盐酸反应最激烈的是钾,反应速率最慢的是铝;生成1mol氢气需要得到2mol电子,1mol钾、钠都失去1mol电子,1mol镁失去2mol电子,而1mol铝失去3mol电子,所以生成氢气最多的是金属铝;
(2)氯气氧化性强于硫单质,所以氯气能够与硫离子反应生成硫,反应的离子方程式为:S2-+Cl2═S↓+2Cl-;
(3)HClO是共价化合物,氧原子分别和H原子、Cl原子各形成一个共用电子对,其电子式为![]() ;
;
II.(1)尾气处理装置中,有缓冲装置的能防止倒吸,干燥管D有缓冲作用,所以能防止倒吸;
(2)浓盐酸和酸性高锰酸钾溶液发生氧化还原反应生成Cl2,Cl2具有氧化性,能氧化I-生成I2,碘遇淀粉试液变蓝色,C装置中看到的现象是溶液变蓝色;用NaOH吸收氯气的尾气,反应生成NaCl和NaClO,发生反应的离子方程式为Cl2+2OH- = Cl- + ClO- +H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
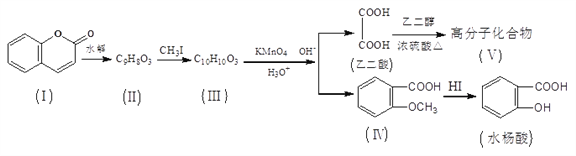
【题目】香豆素(结构如下图中I所示)是用途广泛的香料,由香豆素经下列图示的步骤可转变为水杨酸。
已知:CH3CH=CHCH2CH3 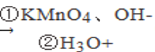 CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
请回答下列问题:
(1)香豆素分子中的官能团的名称为__________,步骤II→III的反应类型为________。
(2)有机物III的结构简式为_________,在上述转化过程中,设计反应步骤II→III的目的是________________________。
(3)下列关于有机物I、II、III、IV的叙述中正确的是________(选填序号)。
A.可用FeCl3溶液来鉴别II和III B.IV中核磁共振氢谱共有4种峰
C.I、II、III均可使溴的四氯化碳溶液褪色 D.1molI最多能和5molH2发生加成反应
(4)写出水杨酸与过量NaHCO3溶液反应的化学方程式_____________。
(5)化合物IV有多种同分异构体,符合下列两个条件的芳香族同分异构体共有_____种。
①遇氯化铁溶液发生显色反应
②能发生水解反应和银镜反应
其中,核磁共振氢谱共有5种吸收峰,且吸收峰面积比为1:2:2:2:1同分异构体的结构简式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均是短周期元素,其原子序数依次增大,A和B同周期,A和D同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素。请回答:
(1)D在元素周期表中的位置是___________________________。
(2)C2B的电子式是__________________。
(3)B、C、E的离子半径由大到小的顺序为__________________(用化学式回答,下同);A、D、E元素最高价氧化物对应水化物的酸性由强到弱为_________________。
(4)B的气态氢化物与H2S相比沸点高的是_________(用化学式回答);原因是___________。
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生异味,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀MnO2,当消耗13.50gEB2时,共转移了1mol电子,则反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)有机物M的合成路线如下图:
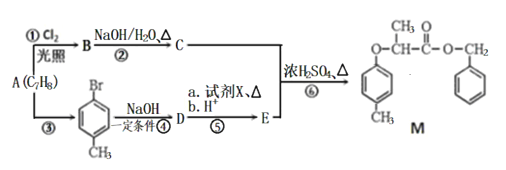
已知:i: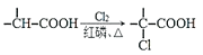 ii:
ii: 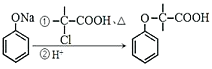
(1)M中含氧官能团的名称有醚键和___________,C的名称为___________,步骤⑥的反应类型为___________。
(2)步骤④反应的化学方程式为_________________________________。
(3)试剂X的结构简式为___________。
(4)同时满足下列条件,E的同分异构体有__________种。
I.能与FeCl3溶液发生显色反应;II.能发生水解反应和银镜反应;III.苯环上只有两个取代基。
其中核磁共振氢谱峰面积比为1:1:2:2:6的分子的结构简式为: ______________________。
(5)根据以上信息,写出以![]() 为原料制取
为原料制取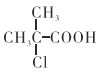 的合成路线图 (无机试剂一定要选银氨溶液,其它无机试剂任选)____________________________________________。合成路线图示例:CH2=CH2
的合成路线图 (无机试剂一定要选银氨溶液,其它无机试剂任选)____________________________________________。合成路线图示例:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点。已知铊有两种天然同位素![]() 和
和![]() 。下列关于
。下列关于![]() 说法正确的是( )
说法正确的是( )
A. 中子数与质子数之差为122B. 中子数与电子数之差为122
C. 质量数与中子数之差为81D. 质量数与电子数之差为81
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。

(1)比较两实验装置,图2所示装置的优点是:
①能更好地吸收有毒气体SO2,防止其污染环境;
②_________________________________________________。
(2)能说明有SO2气体产生的实验现象是_________________________。
(3)反应一段时间后,用滴管吸取A试管中的溶液滴人适量水中为试样,试样中所含金属离子的成分有以下三种可能:
I.只含有Fe3+;II.只含有Fe2+;III.既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
A.稀盐酸溶液 B.稀硫酸溶液 C.KSCN溶液 D.KMnO4溶液
E.NaOH溶液 F.淀粉—KI溶液 G.H2O2溶液
验证Ⅱ:取试样,先滴加少量的____________(填试剂序号,下同),振荡,再滴加少量的___________,根据溶液颜色的变化可确定假设Ⅱ是否正确。
验证Ⅲ:步骤l 取试样,滴加少量的______________(填试剂序号),溶液的颜色变____色,则试样中含有Fe3+,发生反应的离子方程式为________。
步骤2 再取适量的试样滴加少量的_______________________ (填试剂序号),溶液的颜色变为_____________,则试样中含有Fe2+。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度晶体硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场 “革命”。它的制备方法如下图所示,下列说法正确的是
![]()
A. 步骤①的化学方程式为:SiO2+C![]() Si+CO2↑
Si+CO2↑
B. 灼烧熔融的Na2CO3固体,可用石英坩埚
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点67.6℃),可通过蒸馏(或分馏)提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为________(填“吸热”或“放热”)反应。
②已知拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___________________________________________。
(2)实验室用50mL0.50mol·L-1盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有两处明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名称为___________________________;实验室提供了0.50mol·L-1和0.55mol·L-1两种浓度的NaOH溶液,应选择___________mol·L-1的NaOH溶液进行实验。

(3)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:

①在阳极区发生的反应包括__________________________________和H++HCO===H2O+CO2↑。
②简述CO![]() 在阴极区再生的原理:____________________________________。
在阴极区再生的原理:____________________________________。
(4)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,试计算溶液中![]() =_______。(常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)
=_______。(常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com