
【题目】Ba(OH)2 是一种强碱,可用于测定天然气中 CO2 的含量。
(1)CO2 的密度比空气______(填“大”或“小”)
(2)①称取5.25g 试样[含有 Ba(OH)2xH2O 和杂质]配成 100 mL 溶液,配制溶液中用到的仪器有天平、药匙、量筒、烧杯、玻璃棒、______、胶头滴管。用 15.00 mL 0.2 mol/L盐酸与上述 Ba(OH)2 溶液反应,消耗该 Ba(OH)2溶液 10.00 mL(杂质不与酸反应)
②另取5.25 g 试样加热至失去全部结晶水(杂质不分解),称得剩余固体质量为3.09 g, 求 Ba(OH)2xH2O中的 x=______________。
【答案】大 100mL 容量瓶 8
【解析】
(1)空气的平均摩尔质量为29g/mol,二氧化碳的相对分子质量是44 CO2,相同条件下,气体摩尔质量越大,密度越大,则CO2密度比空气大。
故答案为:大;
(2)配制100 mL 溶液用到的仪器有天平、药匙、量筒、烧杯、玻璃棒、100 mL容量瓶、胶头滴管。
①15.0mL0.200mol·L1盐酸溶液中HCl的物质的量为0.015L×0.2mol/L=0.003mol,
设取出的10mL溶液中氢氧化钡的物质的量为n,则:
Ba(OH)2+2HCl═BaCl2+2H2O,
1mol 2mol
n 0.003mol
故n =0.0015mol
②则5.25g试样含有Ba(OH)2的物质的量为![]() =0.015mol,
=0.015mol,
含有水的物质的量为![]() =0.12mol,
=0.12mol,
所以1: x =0.015mol:0.12mol,解得x=8,
答案为:8。


科目:高中化学 来源: 题型:
【题目】依据所给条件推出的结论不正确的是( )
选项 | 条件 | 结论 |
A | 在水溶液或熔融状态下可以导电的化合物,称为电解质 | 水中存在: |
B | 凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱 |
|
C | 联氨为二元弱碱,在水中的电离方式与氨相似 | 联氨与硫酸形成的酸式盐的化学式为: |
D | 发生化学反应时,接受电子对的物质为酸,提供电子对的物质为碱 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质的焰色反应都呈黄色,A、B与水反应都有气体放出,A与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,同时都生成C的溶液,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能生成D。
(1)写出下列物质的化学式:B____________,E_____________。
(2)写出A→C的化学方程式,并标出电子转移的方向和数目:_______________
(3)写出C→D的离子方程式:________________________________。
(4)写出E→D的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,101KPa 下,将 V L 氯化氢气体溶于水得 V L 水溶液,关于该溶液的叙述正确的是
A.溶液的物质的量浓度为 1 mol/LB.溶液中 c(H+)= ![]() mol/L
mol/L
C.溶液中水分子数和 H+数之比为 1:1D.溶液的物质的量浓度稍小于![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1L0.1mol/L的NH4Cl溶液中,NH4+的数目为0.1NA
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
C. 0.1molH2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA
D. 标准状况下,11.2LCH2Cl2中含有质子数为21.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应 X(g)+Y(g)![]() 2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法正确的是( )
2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法正确的是( )

A. 反应开始时,B容器中化学反应速率快
B. A容器中X的转化率为40%,且比B容器中X的转化率小
C. 打开K一段时间达平衡时,A的体积为1.6aL(连通管中气体体积不计)
D. 打开K达新平衡后,升高B容器温度,A容器体积一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4,硼为+3价)为白色粉末,在干燥空气中稳定,在潮湿空气中分解,是常用的还原剂。偏硼酸钠(NaBO2)易溶于水,不溶于乙醇,易水解。目前有多种工艺可制备NaBH4。
(1)用硼精矿(含有一定量B2O3,及Al2O3、SiO2、Fe2O3等杂质)制取NaBH4的流程如下:

①“溶解”时,B2O3与NaOH反应生成了NaBO2,反应离子方程式为____。
②“除硅铝”步骤加入CaO,而不加入CaCl2的原因有:能将硅、铝以沉淀除去;尽量不带入杂质离子;___。
③“操作2”是将滤液蒸发、结晶、洗涤,其中洗涤选用的试剂最好是_____(填字母)。
a. 冷水 b. 乙醇 c. 氨水 d. NaOH溶液
④“反应1”是MgH2与NaBO2混合得到NaBH4和MgO,其化学方程式为________。
(2)我国孙彦平采用耐腐蚀电极材料,以阳离子交换膜为隔离膜,电解偏硼酸钠的碱溶液,也可以高效制备NaBH4。该工艺阳极产物为________,阴极电极方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示,据图判断正确的是
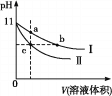
A. Ⅱ为氨水稀释时的pH变化曲线 B. a、b、c三点溶液的导电性:c>b=a
C. a、b、c三点溶液中水的电离程度:c=b>a D. a、b、c三点溶液的KW:c=b<a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com