
【题目】下列有关实验的选项正确的是
A.  配制0.10mol·L-1 NaOH溶液
配制0.10mol·L-1 NaOH溶液
B. 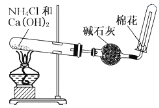 实验室制取干燥的氨气
实验室制取干燥的氨气
C.  萃取碘水中I2,分出水层后的操作
萃取碘水中I2,分出水层后的操作
D. 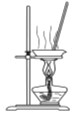 蒸干FeCl2溶液制取FeCl2·4H2O
蒸干FeCl2溶液制取FeCl2·4H2O
【答案】B
【解析】
根据溶液配制、实验室制氨、萃取分液、蒸发结晶等原理、操作要求等分析回答。
A项:一定温度下容量瓶刻度线以下的容积是固定不变的,固体的溶解、浓溶液的稀释、化学反应过程中伴随吸热、放热现象,都不能在容量瓶中进行。NaOH固体溶解会显著放热,A项错误;
B项:实验室加热氯化铵和氢氧化钙的固体混合物制取氨气,用碱石灰除去少量氯化氢和水得干燥的氨气,再用向下排空气法收集,B项正确;
C项:用苯萃取碘水中I2后静置,液体分为两层,密度较大的水层从分液漏斗下口放出后,密度较小的有机层应从分液漏斗上口倒出,C项错误;
D项:FeCl2溶液中存在水解平衡FeCl2+2H2O![]() Fe(OH)2+2HCl,加热时平衡右移直至完全水解。FeCl2·4H2O为结晶水合物,加热也会失去结晶水,不能用蒸发结晶法。加热时还会被空气中的氧气氧化,D项错误。
Fe(OH)2+2HCl,加热时平衡右移直至完全水解。FeCl2·4H2O为结晶水合物,加热也会失去结晶水,不能用蒸发结晶法。加热时还会被空气中的氧气氧化,D项错误。
本题选B。


科目:高中化学 来源: 题型:
【题目】由SO2和O2制备SO3(熔点16.8 ℃,沸点44.8 ℃)的模拟装置如图所示(加热和夹持装置省略):
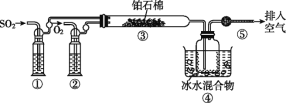
下列说法正确的是( )
A.装置①中的试剂为饱和NaHSO3溶液
B.实验室可用铜与浓硫酸在常温条件下制取SO2
C.装置③反应管中的铂石棉用作反应的催化剂
D.从装置⑤逸出的气体有过量的SO2和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Ni均为Ⅷ族元素,与C、N、O、P等组成的化合物有广泛的用途。回答下列问题:
(1)基态Ni2+的价层电子轨道表达式为________,C、N、O的第一电离能从小到大的顺序为________。
(2)N、P可形成一些复杂离子,如(CH3)3NH+、NO2+、PCl6-等。
①(CH3)3NH+ 中N原子的杂化类型为___,NO2+的空间构型为______________。
②PCl5是一种白色固体,在加压下于148℃时液化,形成一种能导电的熔体。熔体能导电的原因是___________。
(3)Fe、Ni易与CO形成配合物,Fe(CO)5中σ键与π键个数比为______,Ni(CO)4熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂,Ni(CO)4为______晶体。
(4)FeO、NiO的晶体类型与结构和NaCl相同。
① 熔点FeO_____NiO(填“>”、“<”或“=”)。
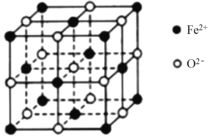
② FeO 晶胞如下图,Fe2+的配位数为_______。
③ FeO在氧气中加热,部分Fe2+被氧化为Fe3+,晶体结构产生铁离子缺位的缺陷,其组成变为FexO(x<1),测得晶胞边长为a cm,密度为g·cm-3,则x=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下物质:①石墨;②水银;③酒精;④氨气;⑤硫化氢;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧冰酷酸(CH3COOH);⑨氧化钠固体; ⑩液态氯化氢。
(1)其中能导电的是_________; 属于非电解质的是_________; 属于电解质的是____________
(2)等质量④和⑤中氢原子的数目之比为_____; 若④和⑤中所含氢原子数相等, 在相同条件下④和⑤的体积之比为____________
(3)向⑥中加入少量⑦请写出离子方程式:____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2O3、Cu2O都是红色粉末,常用作颜料。某校化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO.
提出假设:
假设1:红色粉末是Fe2O3
假设2:______.
假设3:红色粉末是Cu2O和Fe2O3
(1)设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(2)若假设1成立,则实验现象是______.
(3)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?______.简述你的理由______.
(4)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明假设______成立
(5)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产中应用广泛。
Ⅰ.某同学设计如下实验装置测定铜的相对原子质量(夹持和加热仪器已略去),并检验氯气的氧化性。
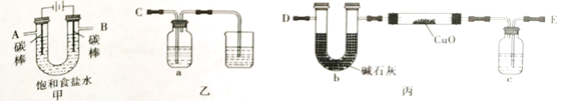
(1)该实验装置的连接顺序为:A连接________,B连接________(填字母)。
(2)乙装置a瓶中的溶液可以是_______
A.NaOH溶液 B.Na2S溶液 C.酸性KMnO4溶液 D.含少量KSCN的FeCl2溶液
(3)对丙装置进行加热前需要________ 。
(4)准确称量 m g CuO进行实验,当CuO完全反应后测出b中增重n g。则Cu的相对原子质量为________ (只要求列出算式)。该实验方案的装置有不合理之处,若不加以改正会导致测定结果________(填“偏大”、”偏小“或”不变“)。
Ⅱ.研究发现Cu与稀盐酸不反应,但在持续通入空气的条件下可反应生成CuCl2。
(5)已知Fe3+对该反应有催化作用,其催化原理如图所示:
![]()
则图中的M‘为________(填化学符号)
(6)向CuCl2溶液中通入H2S气体,可产生CuS沉淀,反应离子方程式为:Cu2++H2S=CuS(s)+2H+ , 则该反应的平衡常数K=________(保留一位小数)。已知:CuS溶度积KSP=1.0×10-36 , H2S电离常数Ka1=1.3×10-7 , Ka2=7.0×10-15。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g) ===2HF(g) ΔH=-270 kJ·mol-1。下列说法正确的是
A. 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和小于2 mol HF(g)的能量
B. 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ
C. 该反应的逆反应是放热反应
D. 该反应过程的能量变化可用下图来表示

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氟利昂-12(CF2Cl2)是甲烷的氯、氟卤代物,它有2种同分异构体
B.对甲基苯甲醛(![]() )使高锰酸钾酸性溶液褪色,说明它含有醛基
)使高锰酸钾酸性溶液褪色,说明它含有醛基
C.溴水可以区分苯和乙酸
D.糖类是食物组成中的重要部分,也是产生能量最高的营养物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油画所用的颜料有许多天然矿石成分,矿石中往往含有B、C、O、Na、P、Cl等元素,它们在科学研究和工业生产中具有许多用途。请回答下列有关问题:
(1)现代化学中,常利用_________上的特征谱线来鉴定元素。
(2)CH3+、-CH3、CH3-都是重要的有机反应中间体。CH3+中碳原子的杂化方式为_________,CH3-的空间构型为_______。
(3) Na+和Ne互为等电子体,电离能I2(Na)______I1(Ne)(填“>”或“<”)。
(4)氢卤酸(HX)的电离过程如图。ΔH1和ΔH2的递变规律都是HF>HCl>HBr>HI,其中ΔH1(HF)特别大的原因为__________,从原子结构分析影响ΔH2递变的因素为__________。

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。
① 磷化硼晶体晶胞如图甲所示:其中实心球为磷原子。已知晶胞中最近的B、P原子的距离为apm,阿伏加德罗常数为NA。则磷化硼晶体的密度为___________g/cm3。(列出计算式即可,不必化简)
② 磷化硼晶胞沿着体对角线方向的投影(图乙中![]() 表示P原子的投影),用
表示P原子的投影),用![]() 画出B原子的投影位置____。
画出B原子的投影位置____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com