
【题目】硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)钙元素的焰色反应呈砖红色,其中红色对应的辐射波长为___nm(填字母)。
A.435 B.500 C.580 D.605 E.700
(2)元素S和Ca中,第一电离能较大的是________(填元素符号),其基态原子外围电子排布式为________。其基态原子中电子的空间运动状态有________种。
(3)硫的最高价氧化物的水合物硫酸能与肼反应生成N2H6SO4,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在________ (填字母)。
A.离子键 B.共价键 C.配位键 D.范德华力
(4)基态Ca原子中,核外电子占据最高能层的符号是________, 该能层为次外层时最多可以容纳的电子数为________。钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金属锰低,原因是________________________。
(5)过氧化钙晶体的晶胞结构如图所示,已知该晶胞的密度是ρg·cm-3,则晶胞结构中最近的两个Ca2+间的距离为______________________nm(列算式即可,用NA表示阿伏加德罗常数的数值)。与Ca2+紧邻O22-的个数为________。

【答案】 E S 3s23p4 9 D N 18 Ca原子半径较大且价电子数较少,金属键较弱  6
6
【解析】(1)钙元素的焰色反应呈砖红色,其中红色对应的辐射波长为700nm,故选E;
(2)S原子吸引电子的能力大于Ca原子,第一电离能较大的是S,S是16号元素,基态原子外围电子排布式为3s23p4。S的基态原子中电子的空间运动状态有1s、2s、2px、2py、2pz、3s、3px、3py、3pz,共9种空间运动状态,故答案为:S;3s23p4;9;
(3)N2H6SO4和(NH4)2SO4都是离子晶体,N2H6 2+和SO42-之间存在离子键,N2H62+中N和H之间形成6个共价键(其中2个配位键),N和N之间形成共价键,SO42-中S和O之间形成共价键,不含范德华力,故选D;
(4)基态Ca原子含有4个电子层,核外电子占据最高能层的符号是N,原子核外次外层的电子数不超过18个。Ca原子半径较大且价电子数较少,导致钙中金属键较弱,使得金属钙的熔点、沸点等都比金属锰低,故答案为:N;18;Ca原子半径较大且价电子数较少,金属键较弱;
(5)根据晶胞结构图,晶胞中Ca2+数为8×![]() +6×
+6×![]() =4,O22-的数为1+12×
=4,O22-的数为1+12×![]() =4。1mol晶胞的质量为4×72g,1mol晶胞的体积为
=4。1mol晶胞的质量为4×72g,1mol晶胞的体积为![]() =
=![]() cm3,则晶胞的边长为
cm3,则晶胞的边长为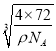 cm=
cm= ×107 nm,晶胞结构中最近的两个Ca2+间的距离为晶胞边长的
×107 nm,晶胞结构中最近的两个Ca2+间的距离为晶胞边长的![]() ,即距离为
,即距离为![]() ×
× ×107 nm;根据晶胞结构图,与Ca2+紧邻O22-的个数为6个,故答案为:
×107 nm;根据晶胞结构图,与Ca2+紧邻O22-的个数为6个,故答案为: ![]() ×
× ×107;6。
×107;6。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式为:
①C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol
②CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H2=﹣870.3kJ/mol
③H2(g)+ ![]() O2(g)=H2O(l)△H3=﹣285.8kJ/mol
O2(g)=H2O(l)△H3=﹣285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的反应热(焓变)为( )
A.+488.3kJ/mol
B.﹣488.3kJ/mol
C.﹣244.15kJ/mol
D.+244.15kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有非常丰富的化学资源,从海水中可提取多种化工原料。某工厂对海水资源综合开发利用的部分工艺流程图如下。回答下列问题:

(1)精制食盐水时下列物质中,用到的有______________________(填序号)。
①NaOH溶液 ②盐酸 ③K2CO3溶液 ④BaCl2溶液 ⑤硫酸 ⑥Na2CO3溶液 ⑦Ba(NO3)2溶液
(2)工业上经过②、③、④制备Ba2。步骤②中Cl2氧化Br-应在________(填酸性或碱性)条件下进行;步骤③Br2可用热空气吹出,其原因是_____________________。
(3)为了除去工业Br2中微量的Cl2,可向工业Br2中____________________。
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
(4)若步骤⑤所得Mg(OH)2沉淀中混有Ca(OH)2杂质,写出除去杂质的实验步骤 ________________(写出加入的试剂和操作)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是:

A. 用图(a)所示装置除去氯气中含有的少量氯化氢
B. 用图(b)所示装置蒸发氯化钠溶液制备氯化钠晶体
C. 用图(c)所示装置制取少量纯净的二氧化碳气体
D. 用图(d)所示装置分离苯萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L的盐酸进行滴定,试回答:
(1)托盘天平称量5.0g固体试剂,用蒸馏水溶解于烧杯中,并振荡,然后立即直接转入500mL容量瓶中,恰好至刻度线,配成待测液备用.请改正以上操作中出现的五处错误.① , ② , ③ , ④ , ⑤ .
(2)将标准盐酸装在25.00mL滴定管中,调节液面位置在处,并记下刻度.
(3)取20.00mL待测液,待测定.该项实验操作的主要仪器有 . 用试剂作指示剂时,滴定到溶液颜色由刚好至色时为止.
(4)滴定达终点后,记下盐酸用去20.00mL,计算NaOH的质量分数为 .
(5)试分析滴定偏低误差可能由下列哪些实验操作引起的 .
A.转移待测液至容量瓶时,未洗涤烧杯
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸
C.滴定时,反应容器摇动太激烈,有少量液体溅出
D.滴定到终点时,滴定管尖嘴悬有液滴
E.读数(滴定管)开始时仰视,终点时俯视.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含48.6% 的SiO2、16.2% 的ZnO、19.4% 的ZnS 和12 .8% 的CuS 及少量的Fe3O4。.某同学用10.0g该废催化剂为原料,回收锌和铜。采用的实验方案如下,回答下列问题:

已知:金属Zn 与Al类似,都是两性金属,能溶于强碱并放出氢气,但铝不溶于氨水,锌却可以溶于氨水形成四氨合锌配离子[Zn(NH3)4]2+。
(1)滤液1中含有Fe2+,选用提供的试剂进行检验,检验方法如下:__________________________。(提供的试剂:稀盐酸、KSCN 溶液、KMnO4 溶液、NaOH 溶液、K3[Fe(CN)6]溶液)
(2)滤渣2 除SiO2 外的另一成分是____________;第二次浸出时,加热温度不宜过高的原因是___________________;写出第二次浸出的化学反应方程式____________________________________。写出锌溶于氨水的离子方程式____________________________________。
(3)ZnSO4在水中的溶解度,随温度的升高而缓慢增大,从硫酸锌溶液得到七水硫酸锌晶体,可采用的方法是_____________________;析出七水硫酸锌晶体,减压过滤,用于淋洗七水硫酸锌晶体的溶剂是___________________;某同学在实验完成之后,得到5.74gZnSO4·7H2O(式量287)则锌的回收率为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有24mL浓度为0.05mol·L-1的Na2SO3溶液恰好与20mL浓度为0.02mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
A.+2B.+3C.+4D.+5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有pH为13的Ba(OH)2、NaOH的混合液100mL,从中取出24mL.用0.025mol/LH2SO4滴定,当滴定至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半.求:①当滴到沉淀不再增加时(溶液体积变化忽略不计),溶液的pH=________(已知:lg2=0.3).
②原混合溶液中c[Ba(OH)2]=________和c(NaOH)=________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=﹣lg c(M),pCO32﹣=﹣lg c(CO32﹣).下列说法不正确的是( ) 
A.MgCO3、CaCO3、MnCO3 的Ksp依次减小
B.a 点可表示MnCO3 的饱和溶液,且c(Mn2+)=c(CO32﹣)
C.b 点可表示的CaCO3不饱和溶液,且c(Ca2+)<c(CO32﹣)
D.c 点可表示MgCO3 的不饱和溶液,且c(Mg2+)<c(CO32﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com