
【题目】根据图示填空。
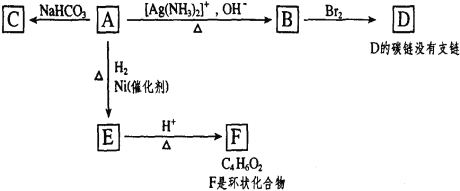
(1)化合物A含有的官能团是___。
(2)由A生成B的反应类型是___,由E生成F的反应类型是___。
(3)与A具有相同官能团的A的同分异构体的结构简式是___。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是___。
(5)F的结构简式是_______。
(6)1 mol A与2 mol H2反应生成1 mol E,其反应方程式是________。
【答案】碳碳双键、醛基、羧基 氧化反应 酯化反应 ![]()
![]()
![]() 或
或![]() OHC-CH=CH-COOH+2H2
OHC-CH=CH-COOH+2H2![]() HO-CH2-CH-CH2-COOH
HO-CH2-CH-CH2-COOH
【解析】
根据题中各物质的转化关系可知,A能与碳酸氢钠溶液反应,说明A中有羧基,A能发生银镜反应,说明A中有醛基,1 mol A与2 mol H2反应生成1 mol E,说明A中还有一个碳碳双键,A氧化生成B,B酸化后羧酸盐变为羧酸,然后与溴发生加成反应生成D,而D的碳链没有支链,由于反应过程在碳链结构不变,则说明A的碳链也没有支链,所以A为OHCCH=CHCOOH;B为NH4OOCCH=CHCOONH4,D为HOOCCHBrCHBrCOOH;A与NaHCO3反应生成C为OHCCH=CHCOONa,A与氢气加成得E为HOCH2CH2CH2COOH,E能在酸性条件下加热生成F为四个碳原子形成的环状化合物,即E发生酯化反应得F为![]() 或
或![]() ,据此答题。
,据此答题。
由以上分析可知:A为OHCCH=CHCOOH;B为NH4OOCCH=CHCOONH4;C为OHCCH=CHCOONa;D为HOOCCHBrCHBrCOOH;E为HOCH2CH2CH2COOH;F为![]() 或
或![]() 。
。
(1)A为OHCCH=CHCOOH,A分子在含有的官能团是醛基、碳碳双键、羧基;
(2) A为OHCCH=CHCOOH,B为NH4OOCCH=CHCOONH4;由A生成B的反应为氧化反应;
E为HOCH2CH2CH2COOH,F为![]() 或
或![]() ;由E生成F的反应为酯化反应;
;由E生成F的反应为酯化反应;
(3)A为OHCCH=CHCOOH,与A具有相同官能团的A的同分异构体的结构简式是![]() ;
;
(4)B在酸性条件下与Br2反应得到D,D的结构简式是![]() ;
;
(5)F的结构简式是![]() 或
或![]() ;
;
(6)1 mol A与2 mol H2反应生成1 mol E,其反应方程式是OHC-CH=CH-COOH+2H2![]() HO-CH2-CH-CH2-COOH。
HO-CH2-CH-CH2-COOH。


科目:高中化学 来源: 题型:
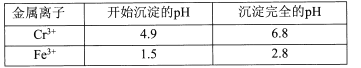
【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如下图所示。

已知:I 在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
II相关金属离子形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(l)滤渣②的主要成分为____(填化学式)。
(2)写出“氧化”步骤中反应的化学方程式____。
(3)“加热”操作的目的是____。
(4)“酸化”过程中发生反应2CrO42-+2H+![]() Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=____
Cr2O72-+H2O (K=4×1014L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=____
(5)“结晶”后得到K2Cr2O7(M=294g.mol-1)产品0.5000 g,将其溶解后用稀H2SO4酸化,再用浓度为1.0000 mol.L-l (NH4)2Fe(SO4)2 标准溶液滴定,滴定终点消耗标准溶液的体积为9.00 mL,则产品的纯度为____。[滴定反应为:K2Cr2O7+6(NH4)2Fe(SO4)2+7H2SO4 =K2SO4 +Cr2(SO4)3 +6(NH4)2SO4+3Fe2(SO4)3+7H2O]
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如下图所示。

①负极的电极反应式为____;
②一段时间后,中间室中NaCl溶液的浓度____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O和CO是环境污染性气体,可在Pt2O+ 表面转化为无害气体,其反应原理为N2O(g) + CO(g)![]() CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
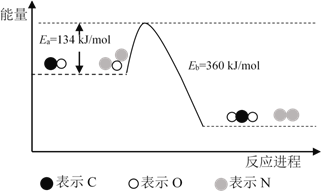
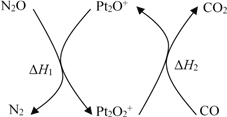
A. ΔH = ΔH1 + ΔH2
B. ΔH = 226 kJ/mol
C. 该反应正反应的活化能小于逆反应的活化能
D. 为了实现转化需不断向反应器中补充 Pt2O+ 和 Pt2O2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

A. 放电时,Li+透过固体电解质向Cu极移动
B. 放电时,负极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH-
C. 通空气时,铜被腐蚀,表面产生Cu2O
D. 整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】隔绝空气加热至500℃时绿矾(硫酸亚铁晶体)能完全分解,某化学小组为探究分解产物的成分,选用下图所示装置进行实验(夹持装置略),A中固体完全分解后变为红棕色粉末。

下列说法不正确的是
A. 所选用装置的正确连接顺序为A-C-E-D-B
B. E装置是用来检验SO3,则X可以是硝酸酸化的硝酸钡溶液
C. 可选用酸性KMnO4溶液检验A装置中残留固体是否为Fe2O3
D. 该反应的化学方程式可能是2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知25℃时硫酸钙的Ksp=9.1×10-6。
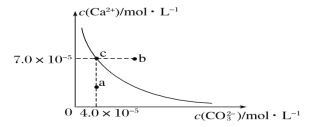
(1)通过蒸发,可使稀溶液由_______点变化到_______点。
(2)在25℃时,反应CaSO4(s)+CO32- (aq)CaCO3(s)+SO42-(aq)的平衡常数K_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000molL-1NaOH溶液滴定20.00mL 0.1000molL-1CH3COOH溶液所得滴定曲线如图:
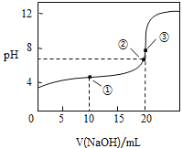
(1)在整个实验过程中,不需要的仪器是 ______ (填序号).
a.100mL容量瓶 b.锥形瓶 c.滴定管夹 d.漏斗 e.玻璃棒 f.滴定管
(2)点②所示溶液为中性:c(Na+)________c(CH3COO-)(填“>”“<”或“=”)。
(3)盛装标准NaOH溶液选择图中滴定管_________(填标号)。
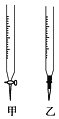
(4)滴定时边滴边摇动锥形瓶,眼睛应注意观察____________。
(5)下列操作会导致测定结果偏低的是______。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0-4mol/L的KMnO4溶液。
Ⅰ、滴定终点的现象是_________________________________。
Ⅱ、计算:血液中含钙离子的浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】”生活无处不化学”.下列关于生活中的问题解释不合理的是
A.食盐不慎洒落在 天然气的火焰上,观察到黄色火焰,其原因:2Na+O2![]() Na2O2
Na2O2
B.沾水的铁制品器皿高温灼烧会发黑,其可能原因:3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
C.Al(OH)3可用于中和过多的胃酸,其原因:Al(OH)3+3HCl=AlCl3+3H2O
D.明矾可以净水,是因为明矾[KAl(SO4)2·H2O]溶于水能生成Al(OH)3胶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com