
【题目】有3.2g CuO、Fe2O3 混合物跟足量CO充分反应后固体减少了0.72g,反应后全部气体用50mL 0.7mol·L-1 Ba(OH)2溶液吸收。下列有关叙述中正确的是
A.反应中生成的CO2体积为1.008 L
B.吸收CO2后的溶液中一定不含Ba(HCO3)2
C.原混合物中CuO与Fe2O3 质量比为3:1
D.若将质量相同的混合物加过量硫酸溶解后,再加入100mLNaOH溶液时沉淀达最大量,由此可求得c(NaOH)= 0.75 mol·L-1
【答案】C
【解析】
A.CuO、Fe2O3混合物跟足量CO充分反应,固体减少质量为混合物中含有的氧元素的质量,CO分子获得1个O原子形成CO2分子,故![]() ,故标况下二氧化碳的体积=0.045mol×22.4L/mol=1.008L,但题干未告知是在标准状况下,二氧化碳的气体摩尔体积不一定为22.4L/mol,A错误;
,故标况下二氧化碳的体积=0.045mol×22.4L/mol=1.008L,但题干未告知是在标准状况下,二氧化碳的气体摩尔体积不一定为22.4L/mol,A错误;
B.n[Ba(OH)2]=0.7mol/L×0.05L=0.035mol,故n(CO2):n[Ba(OH)2]=0.045mol:0.035mol=9:7,介于1:1与2:1之间,故生成碳酸钡与碳酸氢钡, B错误;
C.CuO、Fe2O3混合物跟足量CO充分反应,固体减少质量为混合物中含有的氧元素的质量,混合物中氧原子的物质的量为0.045mol,令混合物中CuO、Fe2O3的物质的量分别为xmol、ymol,根据二者质量之和列方程为:80x+160y=3.2g①,根据氧原子的物质的量之和列方程为x+3y=0.045mol②,联合解①②方程组可得x=0.03mol y=0.005mol,故m(CuO)=0.03mol×80g/mol=2.4g,m(Fe2O3)=0.005mol×160g/mol=0.80g,故二者质量比为3:1, C正确;
D.由于硫酸过量,不能确定NaOH的物质的量,不能确定氢氧化钠的物质的量浓度,D错误;
故答案为:C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A. 加催化剂有利于氨的催化氧化反应
B. 实验室用排饱和食盐水的方法收集氯气
C. 500℃左右比室温更有利于合成氨的反应
D. 压缩H2(g)、I2(g)、HI(g)平衡体系,体系颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/L CH3COOH溶液加入水稀释或加入少量CH3COONa晶体时,都会引起
A. 溶液中pH增大B. CH3COOH的电离程度变大
C. 溶液的导电能力减弱D. CH3COO-的浓度变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 都是元素周期表中前20号主族元素,原子序数依次增大,
都是元素周期表中前20号主族元素,原子序数依次增大,![]() 是地壳中含量最高的元素,
是地壳中含量最高的元素,![]() 、
、![]() 、
、![]() 同周期,
同周期,![]() 和其他元素既不在同一周期也不在同一主族,
和其他元素既不在同一周期也不在同一主族,![]() 的氢化物及其最高价氧化物对应的水化物均为强酸,且
的氢化物及其最高价氧化物对应的水化物均为强酸,且![]() 、
、![]() 、
、![]() 的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)![]() 四种元素中,原子半径最大的是______(填元素符号);
四种元素中,原子半径最大的是______(填元素符号);![]() 和
和![]() 的简单氢化物中,沸点较低的是______(填化学式)。
的简单氢化物中,沸点较低的是______(填化学式)。
(2)元素![]() 在元素周期表中的位置是______,
在元素周期表中的位置是______,![]() 、
、![]() 的最高价氧化物对应的水化物之间发生反应的化学方程式为____________________________________________________________。
的最高价氧化物对应的水化物之间发生反应的化学方程式为____________________________________________________________。
(3)![]() 、
、![]() 、
、![]() 可以形成多种盐,其中一种盐中
可以形成多种盐,其中一种盐中![]() 、
、![]() 、
、![]() 三种元素的原子个数比为
三种元素的原子个数比为![]() ,该盐的化学名称为______。它的水溶液与
,该盐的化学名称为______。它的水溶液与![]() 的氢化物的水溶液反应可生成
的氢化物的水溶液反应可生成![]() 的单质,该反应的离子方程式______________________________,反应生成
的单质,该反应的离子方程式______________________________,反应生成![]() 的单质时,转移电子______
的单质时,转移电子______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图形象地表示氯化钠的形成过程。下列相关的叙述中不正确的是( )

A.钠原子易失去一个原子,氯原子易得到一个电子
B.钠离子与钠原子有相似的化学性质
C.钠原子与氯原子作用形成![]() 后,其结构的稳定性增强
后,其结构的稳定性增强
D.氯化钠中微粒之间形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】补充完成下表:(请把序号①~⑦的答案填在相应的位置上)
元素 | 甲 | 乙 | 丙 |
元素符号 | ①______ | ②______ | O |
原子结构示意图 |
| ③______ | ④______ |
周期 | 三 | 三 | ⑤______ |
族 | ⑥______ | ⅦA | ⑦______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,0.1mol/L HCl溶液中由水电离出的H+的浓度为_______;
(2)若向氨水中加入少量硫酸铵固体,此时溶液中![]() 将_______;(填“增大”、“减小”或“不变”)
将_______;(填“增大”、“减小”或“不变”)
(3)25℃时,向AgNO3溶液中加入BaCl2溶液和KBr溶液,当两种沉淀共存时,![]() =____;[已知:25℃时,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10 ]
=____;[已知:25℃时,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10 ]
(4)用离子方程式表示NH4F不能用玻璃试剂瓶装的原因________;
(5)25℃时,有下列四种溶液:A. 0.1mol/L CH3COONH4溶液 B. 0.1mol/L CH3COOH溶液 C.0.1mol/L CH3COONa溶液 D.等体积0.4mol/L CH3COOH溶液和0.2mol/L NaOH溶液的混合液(混合液呈酸性)
① 已知A溶液呈中性,试推断(NH4)2CO3溶液呈______性(填“酸”或“碱”或“中”);
② D溶液中除H2O外所有分子、离子浓度由大到小的顺序为________;
③ 上述四种溶液中水的电离程度由小到大的顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为原料,经过一系列反应可以制得酯F(C5H8O4)。B结构中有甲基,1mol B 可以与2mol Na和1mol NaOH反应。
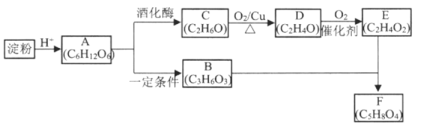
请回答:
(1)E中官能团名称是________。
(2)C→D的反应类型是___________。
(3)D→E的化学反应方程式是_____________。
(4)F的结构简式是____________。
(5)下列说法不正确的是__________。
A 由A生成C时可以产生一种无色无味气体
B 可以用新制Cu(OH)2悬浊液鉴别C、D、E (必要时可以加热)
C 相同物质的量的B、D耗氧量相同
D 1mol F与足量钠反应,消耗钠2mol
(6)检验淀粉在酸性条件下水解产物A (C6H12O6)的操作是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
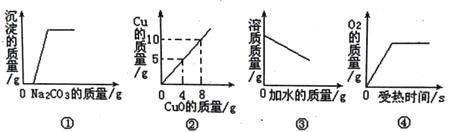
A. 图①是向一定量的稀盐酸和氯化钙的混合溶液中不断滴入碳酸钠溶液至过量
B. 图②是用H2还原CuO来测定CuO中铜元素的含量
C. 图③是向饱和的NaCl溶液中不断加水
D. 图④是用适量的KClO3和MnO2混合物加热制O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com