
ΓΨΧβΡΩΓΩΫΪ4 molAΤχΧεΚΆ2mol BΤχΧε‘Ύ2LΒΡ»ίΤς÷–ΜλΚœΘ§≤Δ‘Ύ“ΜΕ®ΧθΦΰœ¬ΖΔ…ζ»γœ¬Ζ¥”ΠΘΚ2A(g)+B(g)®T2C(g)ΓΘ»τΨ≠2sΚσ≤βΒΟCΒΡ≈®Ε»ΈΣ0.6 molΓΛL-1Θ§œ÷”–œ¬Ν–ΦΗ÷÷ΥΒΖ®Θ§Τδ÷–’ΐ»ΖΒΡ «Θ® Θ©
ΔΌ”ΟΈο÷ A±μ ΨΒΡΖ¥”ΠΒΡΤΫΨυΥΌ¬ ΈΣ0.3 molΓΛL-1ΓΛs-1
ΔΎ”ΟΈο÷ B±μ ΨΒΡΖ¥”ΠΒΡΤΫΨυΥΌ¬ ΈΣ0.6 molΓΛL-1ΓΛs-1
Δέ2s ±Έο÷ AΒΡΉΣΜ·¬ ΈΣ70%
Δή2s ±Έο÷ BΒΡ≈®Ε»ΈΣ0.7molΓΛL-1
A. ΔΌΔέB. ΔΌΔήC. ΔΎΔέD. ΔέΔή
ΓΨ¥πΑΗΓΩB
ΓΨΫβΈωΓΩ
2sΡΎ“‘C±μ ΨΒΡΖ¥”ΠΥΌ¬ vΘ®CΘ©=![]() =0.3mol/Θ®LsΘ©Θ§
=0.3mol/Θ®LsΘ©Θ§
ΔΌΥΌ¬ ÷°±»Β»”ΎΜ·―ßΦΤΝΩ ΐ÷°±»Θ§Υυ“‘vΘ®AΘ©=vΘ®CΘ©=0.3mol®MΘ®lsΘ©Θ§Ι ΔΌ’ΐ»ΖΘΜ
ΔΎΥΌ¬ ÷°±»Β»”ΎΜ·―ßΦΤΝΩ ΐ÷°±»Θ§Υυ“‘vΘ®BΘ©=![]() vΘ®CΘ©=
vΘ®CΘ©=![]() ΓΝ0.3mol®MΘ®LsΘ©=0.15mol®MΘ®LsΘ©Θ§Ι ΔΎ¥μΈσΘΜ
ΓΝ0.3mol®MΘ®LsΘ©=0.15mol®MΘ®LsΘ©Θ§Ι ΔΎ¥μΈσΘΜ
Δέ…ζ≥…ΒΡCΒΡΈο÷ ΒΡΝΩΈΣ0.6molL-1ΓΝ2L=1.2molΘ§ΗυΨίΖΫ≥Χ Ϋ2AΘ®gΘ©+BΘ®gΘ©![]() 2CΘ®gΘ©Ω…÷Σ≤ΈΦ”Ζ¥”ΠΒΡAΒΡΈο÷ ΒΡΝΩΈΣ1.2molΘ§Υυ“‘2s ±Έο÷ AΒΡΉΣΜ·¬ ΈΣ
2CΘ®gΘ©Ω…÷Σ≤ΈΦ”Ζ¥”ΠΒΡAΒΡΈο÷ ΒΡΝΩΈΣ1.2molΘ§Υυ“‘2s ±Έο÷ AΒΡΉΣΜ·¬ ΈΣ![]() ΓΝ100%=30%Θ§Ι Δέ¥μΈσΘΜ
ΓΝ100%=30%Θ§Ι Δέ¥μΈσΘΜ
Δή≈®Ε»±δΜ·ΝΩ÷°±»Β»”ΎΜ·―ßΦΤΝΩ ΐ÷°±»Θ§Υυ“‘2sΡΎBΒΡ≈®Ε»±δΜ·ΝΩΓςcΘ®BΘ©=![]() ΓΝ0.6mol/L=0.3mol/LΘ§Υυ“‘2s ±BΒΡ≈®Ε»ΈΣ
ΓΝ0.6mol/L=0.3mol/LΘ§Υυ“‘2s ±BΒΡ≈®Ε»ΈΣ![]() -0.3mol/L=0.7mol/LΘ§Ι Δή’ΐ»ΖΓΘ
-0.3mol/L=0.7mol/LΘ§Ι Δή’ΐ»ΖΓΘ
Υυ“‘’ΐ»ΖΒΡ «ΔΌΔήΓΘ
Ι ―ΓBΓΘ


 ‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
‘ΡΕΝΩλ≥ΒœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥ΙΧΧεΥα»ΦΝœΒγ≥Ί“‘NaHSO4ΙΧΧεΈΣΒγΫβ÷ ¥ΪΒίH+,ΤδΜυ±ΨΫαΙΙΦϊœ¬ΆΦ,Βγ≥ΊΉήΖ¥”ΠΩ…±μΈΣ:2H2 + O2 = 2H2O,œ¬Ν–”–ΙΊΥΒΖ®’ΐ»ΖΒΡ «

A. ΒγΉ”Ά®ΙΐΆβΒγ¬Ζ¥”bΦΪΝςœρaΦΪ
B. ΟΩΉΣ“Τ0.1molΒγΉ”,œϊΚΡ1.12LΒΡH2
C. bΦΪ…œΒΡΒγΦΪΖ¥”Π ΫΈΣ: O2 + 2H2O + 4e- = 4OH-
D. H+”…aΦΪΆ®ΙΐΙΧΧεΥαΒγΫβ÷ ¥ΪΒίΒΫb
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘Ύ“ΜΕ®Έ¬Ε»œ¬Θ§ΫΪΤχΧεXΚΆΤχΧεYΗς0.16mol≥δ»κ10LΚψ»ίΟή±’»ίΤς÷–Θ§ΖΔ…ζΖ¥”ΠX(g)ΘΪY(g) ![]() 2Z(g) ΓςH < 0Θ§“ΜΕΈ ±ΦδΚσ¥οΒΫΤΫΚβΘ§Ζ¥”ΠΙΐ≥Χ÷–≤βΕ®ΒΡ ΐΨί»γœ¬±μΘΚ
2Z(g) ΓςH < 0Θ§“ΜΕΈ ±ΦδΚσ¥οΒΫΤΫΚβΘ§Ζ¥”ΠΙΐ≥Χ÷–≤βΕ®ΒΡ ΐΨί»γœ¬±μΘΚ
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A. Ζ¥”Π«Α2minΒΡΤΫΨυΥΌ¬ ΠΆ(Z)=2.0ΓΝ10Θ≠3molΓΛLΘ≠1ΓΛmin-1
B. ΤδΥϊΧθΦΰ≤Μ±δΘ§ΫΒΒΆΈ¬Ε»Θ§Ζ¥”Π¥οΒΫ–¬ΤΫΚβ«ΑΠΆ(Ρφ)>ΠΆ(’ΐ)
C. ΗΟΈ¬Ε»œ¬¥ΥΖ¥”ΠΒΡΤΫΚβ≥Θ ΐK=1.44
D. ΤδΥϊΧθΦΰ≤Μ±δΘ§‘Ό≥δ»κ0.2molZΘ§ΤΫΚβ ±XΒΡΧεΜΐΖ÷ ΐ‘ω¥σ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «Θ® Θ©
A. CaCO3Ρ―»ή”ΎΥ°Θ§ «»θΒγΫβ÷
B. Ϋχ––÷–ΚΆΒΈΕ®≤ΌΉς ±―έΨΠ”ΠΉΔ ”ΉΕ–ΈΤΩ÷–»ή“Κ―’…ΪΒΡ±δΜ·
C. ”ΟpH ‘÷Ϋ≤β»ή“ΚΒΡpH”Π‘Λœ»»σ Σ
D. ’τΗ…FeCl3»ή“ΚΩ…ΒΟΒΫFeCl3ΙΧΧε
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ»γΆΦΥυ ΨΒΡΉΑ÷Ο÷–Θ§a «ΫœΜνΤΟΒΡΫπ τΘ§b «≥ΘΈ¬œ¬Μ·―ß–‘÷ Κή≤ΜΜνΤΟ«“ΡήΒΦΒγΒΡΧΦΑτΓΘœ¬Ν–ΙΊ”ΎΉΑ÷ΟΒΡ–π ω≤Μ’ΐ»ΖΒΡ «Θ® Θ©
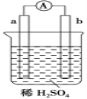
A. ΧΦΑτ…œ”–ΤχΧε≤ζ…ζ
B. a «’ΐΦΪΘ§b «ΗΚΦΪ
C. ΒΦœΏ÷–”–ΒγΉ”ΝςΕ·Θ§ΤδΝςœρΈΣ¥”aΦΪΒΫbΦΪ
D. aΦΪ…œΖΔ…ζΝΥ―θΜ·Ζ¥”Π
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΖ¥”ΠA(g)ΘΪ3B(g) ![]() 2C(g)ΘΪ2D(g)‘ΎΥΡ÷÷≤ΜΆ§«ιΩωœ¬ΒΡΖ¥”ΠΥΌ¬ Ζ÷±πΈΣ
2C(g)ΘΪ2D(g)‘ΎΥΡ÷÷≤ΜΆ§«ιΩωœ¬ΒΡΖ¥”ΠΥΌ¬ Ζ÷±πΈΣ
ΔΌv(A)ΘΫ0.45 molΓΛLΘ≠1ΓΛminΘ≠1 ΔΎv(B)ΘΫ0.6 molΓΛLΘ≠1ΓΛsΘ≠1 Δέv(C)ΘΫ0.4 molΓΛLΘ≠1ΓΛsΘ≠1 Δήv(D)ΘΫ0.45 molΓΛLΘ≠1ΓΛsΘ≠1Θ§ΗΟΖ¥”ΠΫχ––ΒΡΩλ¬ΐΥ≥–ρΈΣ
A. Δή>ΔέΘΫΔΎ>ΔΌ B. Δή<ΔέΘΫΔΎ<ΔΌ C. ΔΌ>ΔΎ>Δέ>Δή D. Δή>Δέ>ΔΎ>ΔΌ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΥα–‘KMnO4‘Ύ…ζ≤ζΓΔ…ζΜνΓΔΈά…ζ“ΫΝΤ÷–≥Θ”ΟΉςœϊΕΨΦΝΘ§ΗΏΟΧΥαΦΊ‘λ≥…ΒΡΈέΉ’Ω…”ΟΜΙ‘≠–‘ΒΡ≤ίΥα(H2C2O4 )»Ξ≥ΐΘ§Fe(NO3)3“≤ «÷Ί“Σ―θΜ· ‘ΦΝΘ§œ¬Οφ «Ε‘’βΝΫ÷÷―θΜ·ΦΝ–‘÷ ΒΡΧΫΨΩΓΘ
Θ®1Θ©»Γ300 mL 0.2 mol/LΒΡKI»ή“Κ”κ“ΜΕ®ΝΩΒΡΥα–‘KMnO4»ή“Κ«ΓΚΟΖ¥”ΠΘ§…ζ≥…Β»Έο÷ ΒΡΝΩΒΡI2ΚΆKIO3Θ§‘ρΉΣ“ΤΒγΉ”ΒΡΈο÷ ΒΡΝΩΒΡ «________molΓΘ
Θ®2Θ©≤βΕ®KMnO4―υΤΖΒΡ¥ΩΕ»Ω…”Ο±ξΉΦNa2S2O3»ή“ΚΫχ––ΒΈΕ®Θ§»Γ0.395 g KMnO4―υΤΖ»ήΫβΥαΜ·ΚσΘ§”Ο0.100 mol/L±ξΉΦNa2S2O3»ή“ΚΫχ––ΒΈΕ®Θ§±ξΉΦNa2S2O3»ή“Κ”Π ΔΉΑ‘Ύ________(ΧνΓΑΥα ΫΓ±ΜρΓΑΦν ΫΓ±)ΒΈΕ®Ιή÷–ΓΘ Β―ι÷–Θ§ΒΈΕ®÷Ν÷’Βψ ±œϊΚΡNa2S2O3»ή“Κ12.50 mLΘ§‘ρΗΟ―υΤΖ÷–KMnO4ΒΡ÷ ΝΩΖ÷ ΐ «________ΓΘ(”–ΙΊάκΉ”ΖΫ≥Χ ΫΈΣΘΚ8MnO4Θ≠+5S2O32Θ≠+14H+ΘΫ8Mn2++10SO42Θ≠+7H2OΘ©
Θ®3Θ©‘ΎFe(NO3)3»ή“Κ÷–Φ”»κNa2SO3»ή“ΚΘ§»ή“Κœ»”…ΉΊΜΤ…Ϊ±δΈΣ«≥¬Χ…ΪΘ§Ιΐ“ΜΜα”÷±δΈΣΉΊΜΤ…ΪΓΘ»ή“Κœ»±δΈΣ«≥¬Χ…ΪΒΡάκΉ”ΖΫ≥Χ Ϋ «_______________Θ§”÷±δΈΣΉΊΜΤ…ΪΒΡάκΉ”ΖΫ≥Χ Ϋ «__________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΉ‘»ΜΫγ÷–¥φ‘ΎΉ≈–μΕύ‘ΣΥΊΒΡ―≠ΜΖΘ§»γΆΦΥυ Ψ―≠ΜΖΒΡ‘ΣΥΊ «(ΓΓΓΓ)

A. «β B. ΧΦ C. ΒΣ D. Νρ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΦΉ―ß…ζ”Ο»γ1ΆΦΥυ ΨΉΑ÷Ο÷ΛΟςδεΚΆ±ΫΒΡΖ¥”Π «»Γ¥ζΖ¥”ΠΕχ≤Μ «Φ”≥…Ζ¥”ΠΘ§÷ς“Σ Β―ι≤Ϋ÷η»γœ¬ΘΚ
Θ®1Θ©Φλ≤ιΉΑ÷ΟΒΡΤχΟή–‘Θ§»ΜΚσœρ…’ΤΩ÷–Φ”»κ“ΜΕ®ΝΩΒΡ±ΫΚΆ“ΚδεΓΘ
Θ®2Θ©œρΉΕ–ΈΤΩ÷–Φ”»κ ΝΩΡ≥“ΚΧεΘ§–Γ ‘Ιή÷–Φ”»κCCl4Θ§≤ΔΫΪ”“±ΏΒΡ≥ΛΒΦΙήΩΎΫΰ»κCCl4“ΚΟφœ¬ΓΘ
Θ®3Θ©ΫΪAΉΑ÷Ο÷–ΒΡ¥ΩΧζΥΩ–Γ–Ρœρœ¬≤ε»κΜλΚœ“Κ÷–ΓΘ

«κΧν–¥œ¬Ν–Ω’ΑΉΘΚ
ΔΌΗυΨίΩΈ±ΨΥυ―ß÷Σ ΕΘΚ±Ϋ «ΤΫΟφ–ΆΖ÷Ή”Θ®Υυ”–‘≠Ή”Ι≤ΤΫΟφΘ©Θ§ΦΉΆι «’ΐΥΡΟφΧε–ΆΖ÷Ή”Θ§”…¥ΥΆΤ≤β![]() ÷–ΉνΕύ______Ηω‘≠Ή”Ι≤ΤΫΟφΓΘ
÷–ΉνΕύ______Ηω‘≠Ή”Ι≤ΤΫΟφΓΘ
ΔΎΉΑ÷ΟBΒΡΉΕ–ΈΤΩ÷––Γ ‘ΙήΡΎCCl4ΒΡΉς”Ο «_______ΘΜ–Γ ‘ΙήΆβΒΡ“ΚΧε «________ΓΘ
ΔέΖ¥”ΠΚσΘ§œρΉΕ–ΈΤΩB÷–ΒΈΦ”______Θ§œ÷œσ «___________________ΓΘ
Δή““Ά§―ß Ι”ΟΆΦ2ΉΑ÷ΟΘ§a÷–Φ”»κ“ΜΕ®ΝΩΒΡ±ΫΘ§“ΚδεΘ§Χζ–ΦΘ§d÷–“ΚΧε»‘”κΆΦ1B÷––Γ ‘ΙήΆβ“ΚΧεœύΆ§Θ§Κσ–χ≤ΌΉς»‘»ΜΈΣΔέΘ§”Ο¥ΥΉΑ÷Ο÷ΛΟςδεΚΆ±ΫΒΡΖ¥”Π «»Γ¥ζΖ¥”ΠΕχ≤Μ «Φ”≥…Ζ¥”ΠΘ§ΦΉ»œΈΣ““Ά§―ßΒΡ Β―ι≤Μ―œΟήΘ§ ‘ΥΒΟς≤Μ―œΟήΒΡάμ”…______________ΓΘ
Δί–¥≥ω±Ϋ”κ“ΚδεΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ____________________________________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com