
【题目】火箭燃料偏二甲肼(CH3)2N-NH2与NO2反应放出巨大的能量,能把500t以上的仪器设备送入太空,这是液体推进剂的优点。
(1)液态偏二甲肼(CH3)2N-NH2与氨气性质相似,易溶于水显弱碱性。易溶于水的原因是_______,写出溶于水后的电离方程式______________。
(2)氨-次氯酸钠法制取偏二甲肼(CH3)2N-NH2原理如下:
反应- NH3+NaClO→NaOH+Cl-NH2
反应二 Cl-NH2+HN(CH3)2→(CH3)2N-NH2+HCl
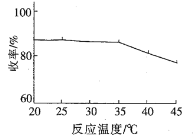
①模拟实验得到温度与收率如下关系图,温度约为_______℃时收率最高,约为________℃以后收率下降,收率下降的主要原因是温度升高,_________挥发所致。
②氯化铵是制取偏二甲肼(CH3)2N-NH2的缓冲剂,模拟实验得到加入氯化铵与收率的关系图如下:
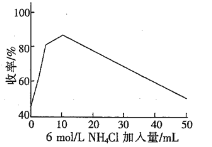
请结合原理知识解释收率升高的原因____________。
(3)固体推进剂如硼铝或纳米铝粉比液体推进剂灌装简单、无需临时加注,但与液体推进剂相比其最大缺点是__________________。
【答案】能够与水分子形成分子间氢键 (CH3)2N-NH2+H2O![]() (CH3)2N-NH3++OH- 25 35 氨气或Cl-NH2或HN(CH3)2 氯化铵与氢氧化钠反应,促进反应一正向移动,Cl-NH2浓度增大,促进反应二正向移动,使得收率升高 推进力不大(或固体推进剂单位时间内产生的气体的物质的量和气体的温度不如液体推进剂,推进力不大)
(CH3)2N-NH3++OH- 25 35 氨气或Cl-NH2或HN(CH3)2 氯化铵与氢氧化钠反应,促进反应一正向移动,Cl-NH2浓度增大,促进反应二正向移动,使得收率升高 推进力不大(或固体推进剂单位时间内产生的气体的物质的量和气体的温度不如液体推进剂,推进力不大)
【解析】
(1)液态偏二甲肼(CH3)2N-NH2与氨气性质相似,能够与水分子形成分子间氢键,类比氨水的电离书写(CH3)2N-NH2的电离方程式;
(2)①根据图像结合常见具有挥发性的物质分析解答;②氯化铵与反应一生成的氢氧化钠反应,导致反应一中氢氧化钠的浓度减小,促进反应一正向移动,Cl-NH2浓度增大,又会促进反应二正向移动,据此分析解答;
(3)可以从固体推进剂单位时间内产生的气体的物质的量和气体的温度与液体推进剂的区别分析解答。
(1)液态偏二甲肼(CH3)2N-NH2与氨气性质相似,能够与水分子形成分子间氢键,使得偏二甲肼易溶于水,溶于水的偏二甲肼能够电离,(CH3)2N-NH2+H2O![]() (CH3)2N-NH3++OH-,溶液显弱碱性,故答案为:能够与水分子形成分子间氢键;(CH3)2N-NH2+H2O
(CH3)2N-NH3++OH-,溶液显弱碱性,故答案为:能够与水分子形成分子间氢键;(CH3)2N-NH2+H2O![]() (CH3)2N-NH3++OH-;
(CH3)2N-NH3++OH-;
(2)①根据图像,温度约为25℃时收率最高,约为35℃以后收率下降,收率下降的主要原因是温度升高,氨气或Cl-NH2或HN(CH3)2挥发所致,故答案为:25;35;氨气或Cl-NH2或HN(CH3)2;
②氯化铵与反应一生成的氢氧化钠反应,导致反应一中氢氧化钠的浓度减小,促进反应一正向移动,Cl-NH2浓度增大,促进反应二正向移动,使得收率升高,故答案为:氯化铵与氢氧化钠反应,促进反应一正向移动,Cl-NH2浓度增大,促进反应二正向移动,使得收率升高;
(3)固体推进剂如硼铝或纳米铝粉比液体推进剂灌装简单、无需临时加注,但与液体推进剂相比,固体推进剂单位时间内产生的气体的物质的量和气体的温度不如液体推进剂,推进力不大,故答案为:推进力不大(或固体推进剂单位时间内产生的气体的物质的量和气体的温度不如液体推进剂,推进力不大)。


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用如图所示实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)回答下列问题:
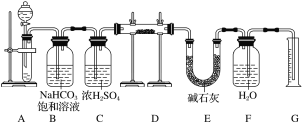
(1)装置A是用来产生CO2气体,则A中液体试剂选用____________,发生反应的离子方程式为___________________。
(2)装置B的作用是_____________________________________________________,装置C的作用是________________________________________________________,装置E中碱石灰的作用是_________________________________________________。
(3)装置D中发生反应的化学方程式为________________________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.纯净草酸亚铁晶体热分解产物的探究。
(1)气体产物成分的探究。小组成员采用如下装置(可重复选用)进行实验:

①装置D的名称为___________。
②按照气流从左到右的方向,上述装置的连接顺序为___________→尾气处理装置(填仪器接口的字母编号)。
③实验前先通入一段时间N2,其目的为______________________。
④实验证明了气体产物中含有CO,依据的实验现象为______________________。
(2)固体产物成分的探究。充分反应后,A处反应管中残留黑色固体。查阅资料可知,黑色固体可能为Fe或FeO。小组成员设计实验证明了其成分只有FeO,其操作及现象为___________。
(3)依据(1)和(2)结论,可知A处反应管中发生反应的化学方程式为___________。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取m g草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液。
步骤2:取上述溶液25.00mL,用c mol· L -1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤3中加入锌粉的目的为____________________________________________。
(5)草酸亚铁晶体样品的纯度为____________________________________________;若步骤1配制溶液时部分Fe2+被氧化,则测定结果将___________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
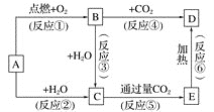
请填写下列空白:
(1)写出化学式:A____,B____,C_____,D____,E____。
(2)以上反应中,属于氧化还原反应的有____________(填写编号)。
(3)A→C反应的离子方程式是________。
(4) B→C反应的化学方程式是____________。
(5)E→D反应的化学方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是( )

A. 形成锌-铜原电池 B. 实验室制备乙酸乙酯
C. 证明酸性:CHCOOH>H2CO3>硅酸 D. 石油的分馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)两种气态烃组成的混合气体,完全燃烧后得到CO2和H2O(g)的物质的量随混合烃的总物质的量的变化如图所示。则该产物混合气体的平均摩尔质量为___________g· mol-1(保留3位有效数字),该混合烃的平均分子式为________________。
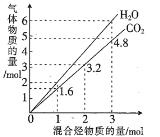
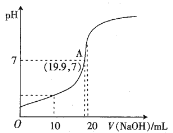
(2)常温下,向20 mL 0.10 mol·L-1HB溶液中逐滴滴入0.10 mol·L-1 NaOH溶液,所得pH曲线如下图所示。则HB是_______酸(填“强”或“弱”),A点对应的溶液中![]() 为_______。
为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,生成物所贮的化学能比反应物所贮化学能要多的是( )
A.CaO+H2O=Ca(OH)2
B.NaOH+HCl=NaCl+H2O
C.CH4+2O2 ![]() CO2+2H2O
CO2+2H2O
D.CO2+C ![]() 2CO
2CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ某无土栽培用的营养液,营养液要求KCl、K2SO4和NH4Cl 3种固体原料的物质的量之比为1:4:8。
(1) 配制该营养液后c(NH4+)=0.016 mol﹒L-1,溶液c(K+)=_______________。
(2) 若采用(NH4)2SO4和KCl来配制该营养液,则(NH4)2SO4和KCl物质的量之比为________
Ⅱ从1L 1 mol﹒L-1氢氧化钠溶液中取出100 mL:
(1)取出的这100 mL氢氧化钠溶液的物质的量浓度是______。若将取出的这100 mL氢氧化钠溶液加水稀释至500 mL,所得溶液的物质的量浓度是_____。
某学生计划用12 mol﹒L-1的浓盐酸配制0.1 mol﹒L-1的稀盐酸450 mL,回答下列问题:
(2)实验过程中,不必使用的是________(填字母)。
A.托盘天平 B.量筒 C.容量瓶 D.250 mL烧杯E.胶头滴管F.500 mL试剂瓶
(3)除上述仪器可使用外,还缺少的仪器是________。
(4)量取浓盐酸的体积为___ mL,应选用的量筒规格为______(提供10.0 mL、25.0 mL)。
(5)配制时应选用的容量瓶规格为______________。
(6)某同学操作出现以下情况,对所配溶液浓度将有何影响(填“偏高”“偏低”或“无影响”)。
定容时俯视刻度线__________加蒸馏水时不慎超过了刻度__________,此时应如何处理 ________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com