
【题目】Ⅰ某无土栽培用的营养液,营养液要求KCl、K2SO4和NH4Cl 3种固体原料的物质的量之比为1:4:8。
(1) 配制该营养液后c(NH4+)=0.016 mol﹒L-1,溶液c(K+)=_______________。
(2) 若采用(NH4)2SO4和KCl来配制该营养液,则(NH4)2SO4和KCl物质的量之比为________
Ⅱ从1L 1 mol﹒L-1氢氧化钠溶液中取出100 mL:
(1)取出的这100 mL氢氧化钠溶液的物质的量浓度是______。若将取出的这100 mL氢氧化钠溶液加水稀释至500 mL,所得溶液的物质的量浓度是_____。
某学生计划用12 mol﹒L-1的浓盐酸配制0.1 mol﹒L-1的稀盐酸450 mL,回答下列问题:
(2)实验过程中,不必使用的是________(填字母)。
A.托盘天平 B.量筒 C.容量瓶 D.250 mL烧杯E.胶头滴管F.500 mL试剂瓶
(3)除上述仪器可使用外,还缺少的仪器是________。
(4)量取浓盐酸的体积为___ mL,应选用的量筒规格为______(提供10.0 mL、25.0 mL)。
(5)配制时应选用的容量瓶规格为______________。
(6)某同学操作出现以下情况,对所配溶液浓度将有何影响(填“偏高”“偏低”或“无影响”)。
定容时俯视刻度线__________加蒸馏水时不慎超过了刻度__________,此时应如何处理 ________。
【答案】0.018mol/L 4:9 1mol/L 0.2mol/L A 玻璃棒 4.2 mL 10.0mL 500 mL 偏高 偏低 重新配制
【解析】
Ⅰ由配制营养液的KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8可知,溶液中K+和NH4+的物质的量比为(1+2×4):8=9:8,由K+和NH4+的物质的量比计算可得;
Ⅱ溶液是均匀的,从1L 1 mol﹒L-1氢氧化钠溶液中取出的100mLNaOH溶液浓度等于原溶液的浓度,由稀释定律计算可得;配置一定物质的量浓度的溶液,配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,需要用到的仪器有量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管、和500 mL试剂瓶。
Ⅰ(1)由配制营养液的KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8可知,溶液中K+和NH4+的物质的量比为(1+2×4):8=9:8,若营养液中c(NH4+)为0.016 mol﹒L-1,n(K+):n(NH4+)=c(K+):c(NH4+)=9:8,则c(K+)=![]() =0.018mol/L,故答案为:0.018mol/L;
=0.018mol/L,故答案为:0.018mol/L;
(2)设(NH4)2SO4的物质的量为x,KCl的物质的量的物质的量为y,由溶液中K+、NH4+的物质的量比为9:8可得y:2x=9:8,则x:y=4:9,故答案为:4:9;
Ⅱ(1)溶液是均匀的,从1L 1 mol﹒L-1氢氧化钠溶液中取出的100mLNaOH溶液浓度等于原溶液的浓度,则取出的这100 mL氢氧化钠溶液的物质的量浓度是为1mol/L;据稀释定律,稀释前后溶质氢氧化钠的物质的量不变,令稀释后的浓度为c,则可得关系式100mL×1mol/L=500mL×c,解得c=0.2mol/L,故答案为:1mol/L ;0.2mol/L;
(2)配置一定物质的量浓度的溶液,配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,需要用到的仪器有量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管、和500 mL试剂瓶,不必使用的是托盘天平,故答案为:A;
(3)由(2)分析可知,还缺少的仪器是玻璃棒,故答案为:玻璃棒;
(4)设量取浓盐酸的体积是Vml,由稀释定律可知稀释前后HCl物质的量不变,则有12mol/L×V×10—3L=0.10mol/L×0.5L,解得V=4.2,由量筒使用的最近原则可知,应选用10.0mL量筒量取4.2ml浓盐酸,故答案为:4.2ml;10.0mL;
(5)实验室没有450mL的容量瓶,则配制0.1 mol﹒L-1的稀盐酸450 mL应选用500mL的容量瓶,故答案为:500 mL;
(6)定容时俯视刻度线,会导致溶液体积偏小,所配溶液浓度偏高;加蒸馏水时不慎超过了刻度,会导致溶液体积偏大,所配溶液浓度偏低,由于操作导致实验失败,解决的方法是重新配制,故答案为:偏高;偏低;重新配制。


科目:高中化学 来源: 题型:
【题目】火箭燃料偏二甲肼(CH3)2N-NH2与NO2反应放出巨大的能量,能把500t以上的仪器设备送入太空,这是液体推进剂的优点。
(1)液态偏二甲肼(CH3)2N-NH2与氨气性质相似,易溶于水显弱碱性。易溶于水的原因是_______,写出溶于水后的电离方程式______________。
(2)氨-次氯酸钠法制取偏二甲肼(CH3)2N-NH2原理如下:
反应- NH3+NaClO→NaOH+Cl-NH2
反应二 Cl-NH2+HN(CH3)2→(CH3)2N-NH2+HCl
①模拟实验得到温度与收率如下关系图,温度约为_______℃时收率最高,约为________℃以后收率下降,收率下降的主要原因是温度升高,_________挥发所致。
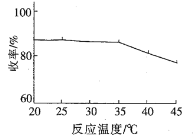
②氯化铵是制取偏二甲肼(CH3)2N-NH2的缓冲剂,模拟实验得到加入氯化铵与收率的关系图如下:
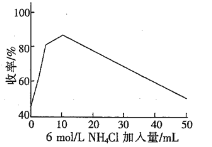
请结合原理知识解释收率升高的原因____________。
(3)固体推进剂如硼铝或纳米铝粉比液体推进剂灌装简单、无需临时加注,但与液体推进剂相比其最大缺点是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是NO2和O2形成的原电池装置。下列说法不正确的是
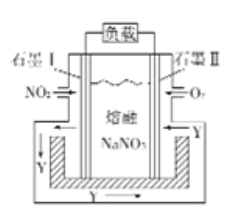
A. 石墨Ⅱ做正极,O2发生还原反应
B. 该电池放电时NO3-从右侧向左侧迁移
C. 当消耗1mol NO2时,电解质中转移1mol e
D. 石墨Ⅰ附近发生的反应为NO2+NO3--e-=N2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨时,在某个密闭容器中发生反应:3H2(g)+N2(g)![]() 2NH3(g)
2NH3(g)
(1)下列能使反应速率加快的是_____________________
①升高温度 ②减小容器体积 ③通入N2 ④通入Ar使压强增大 ⑤通入HCl气体 ⑥加入合适的催化剂
A.①③④⑤ B.①②③⑥ C.①②③④ D.②④⑤⑥
(2)在恒温、恒容的条件下,下列说法能表示反应达到化学平衡状态的是__________
①当有1molN2被消耗,就有2molNH3生成
②当有6molH—H键形成时,就有12molN—H键形成
③2![]() 正(N2)=
正(N2)=![]() 逆(NH3)
逆(NH3)
④N2的物质的量不再变化
⑤H2、N2、NH3的浓度之比等于3:1:2
⑥混合气体的密度不变
⑦混合气体的压强不变
⑧混合气体的平均相对分子质量不变
A.①③④⑤⑦ B.①②③④⑧ C.②③④⑦⑧ D.②④⑤⑥
(3)在2 L定容密闭容器中通入1 mol N2(g)和3 mol H2(g),发生反应:3H2(g)+N2(g)![]() 2NH3(g)(放热反应)。测得压强-时间图像如图甲,测得p2=0.8p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如图乙图像。
2NH3(g)(放热反应)。测得压强-时间图像如图甲,测得p2=0.8p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如图乙图像。
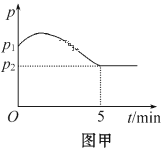
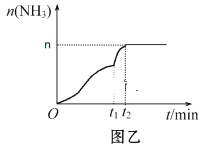
①如图甲,反应开始至平衡时NH3的平均反应速率为_____________________,平衡时氢气的转化率为_________。
②如图乙,下列说法正确的是_________
A.t1时刻可能是加入了催化剂
B.改变条件可以使H2 100℅转化为NH3
C.增大N2的浓度,可以提高H2的转化率
D.t2时刻,N2的浓度与NH3的浓度之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
③KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
试回答下列问题:
(1)当反应①转移3 mol电子时,消耗H2SO4的质量是______g,产生氢气的体积(标准状况)________L。
(2)反应②中________作氧化剂,________是氧化产物。
(3)当反应②中生成11.2 L SO2气体(标准状况下)时,被还原的H2SO4的物质的量是________。
(4)用单线桥法表示反应②电子转移的方向和数目(在化学方程式上标出)__________。
(5)反应③中氧化产物与还原产物的物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100 mL 1.0 mol/LNa2CO3溶液,下列操作正确的是
A. 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置的说法不正确的是
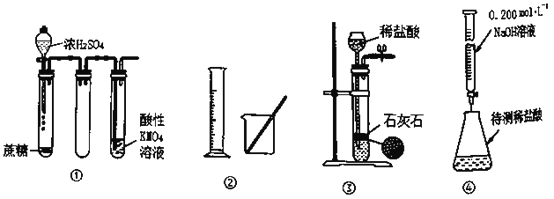
A.装置①中酸性高锰酸钾溶液中出现气泡,且颜色逐渐褪去
B.利用②中仪器可以配置75%的酒精溶液
C.装置③可用于实验室制备CO2气体
D.装置④可用来测定未知浓度的稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下CH3COOH和NH3·H2O的电离平衡常数分别为Ka、Kb。若在常温下向0.1mol/L的醋酸溶液中逐滴加入相同浓度的氨水直至完全过量,则下列说法正确的是
A. 加入氨水的过程中,溶液的导电性一直不断增强
B. CH3COONH4在水溶液中的水解平衡常数Kh=Kw/(Ka+Kb)
C. 若Ka≈Kb,当加入等体积的氨水时,溶液基本呈中性
D. 该等式在滴加过程中始终成立c(CH3COO-)+c(CH3COOH)=c(NH4+)+c(NH3·H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com