
下列关于化学用语的表示错误的是
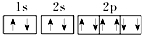 A、Na+的电子排布图:
A、Na+的电子排布图:

B、氯离子的结构示意图
|
|
| D、硫离子的核外电子排布式:1s22s22p63s23p6 |
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
下列操作不能达到目的的是
A.将25g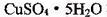 溶于100 mL蒸馏水中,配制100mol l.0 mol/LCuSO4溶液
溶于100 mL蒸馏水中,配制100mol l.0 mol/LCuSO4溶液
B.检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的红色石蕊试纸检验逸出的 气体
C.用加热分解的方法区分碳酸钠和碳酸氢钠两种固体
D.用银氨溶液鉴别葡萄糖和蔗糖
查看答案和解析>>
科目:高中化学 来源: 题型:
用过量的锌和500mL稀硫酸反应制氢气,当反应停止时,制得氢气67.2L(标准状况下),试求稀硫酸的物质的量浓度。(计算要求列式并带单位进行计算,只有结果不给分。)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组反应,均可用同一离子方程式表示的是 ( )
A.HCl和Na2CO3溶液反应, HCl溶液和CaCO3反应
B.足量稀H2SO4和Na2CO3溶液反应, 足量稀HNO3和K2CO3溶液反应
C.稀H2SO4和Ba(OH)2溶液反应, 稀H2SO4和KOH溶液反应
D.BaCO3和稀 H2SO4溶液反应, BaCO3和稀HCl 溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
写出下列反应的离子方程式。
①稀硫酸与NaOH溶液反应的离子方程式:
________________________________________________________________________
②足量稀硝酸与CaCO3溶液反应的离子方程式:
________________________________________________________________________
③锌与稀硫酸反应的离子方程式:
________________________________________________________________________
④稀硫酸和氢氧化钡溶液反应的离子方程式:
⑤等体积等物质的量浓度的碳酸氢钠溶液和氢氧化钡溶液反应的离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列物质:
①金刚石②干冰③氯化铵④氖⑤金属锌⑥石英⑦硫化氢
(1)通过非极性键形成原子晶体的是 ;属于分子晶体,且分子为直线型的是 ;由单原子分子构成的分子晶体是 ;含有极性键的离子化合物是 ;能导电且为金属晶体的是 。(均填序号)
(2)有下列粒子:
①CCl4 ②SO3 ③P4 ④H3O+ ⑤CO32- ⑥PH3
其中属于非极性分子的是 ;粒子立体构型为平面三角形的是 ;粒子立体构型为三角锥形的是 ;粒子立体构型为四面体的是 。(均填序号)
(3)某+3价离子的电子排布式为1s22s22p63s23p63d5,则该元素在周期表中的位置是在 周期 族,画出该元素的原子结构示意图 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数
D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,增大反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学反应 3 A  2 B + D在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表:
2 B + D在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表:
| 实验 序号 |
| 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
根据上述数据,完成下列填空:
(1)在实验 1 中,反应在10 min ~20 min 内平均速率为_________ mol /(L·min)
(2)在实验 2 中,A 的初始浓度 C2 为 __________ mol / L ,可推测实验 2 中还隐含的条件是____________________________
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3 ____v1 (填 <、>或=),且C3 ______ 2.0 mol / L (填 <、>或=)
查看答案和解析>>
科目:高中化学 来源: 题型:
现代炼锌的方法可分为火法和湿法两大类.火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和足量焦炭混合,在鼓风炉中加热至1373~1573K,使锌蒸馏出来.主要反应为:
焙烧炉中:2ZnS+3O2=2ZnO+2SO2 ①
鼓风炉中:2C+O2=2CO ②
ZnO(s)+CO(g)⇌Zn(g)+CO2(g)③
假设鼓风炉体积固定且密闭,随反应的进行鼓风炉内不同时间气态物质的物质的量浓度(mol/L)如下表
| 反应进行时间/min | CO | Zn | CO2 |
| 0 | 0.11 | 0 | 0 |
| 2 | 0.1 | 0.01 | 0.01 |
| 30 | c1 | C2 | C2 |
| 35 | c1 | C2 | C2 |
(l)若保持温度不变,在鼓风炉中增大CO的浓度,K值 不变 填“增大’、“减小”或“不变”);
(2)已知:该温度时,化学平衡常数K=1.0,则表中c1= 0.01mol/L (写出计算过程)
(3)通过改变反应条件,使焙烧炉中反应①的ZnO几乎完全被CO还原,焙烧炉和鼓风炉消耗的O2的体积比不超过 3:1 .
(4)若起始浓度不变,通过改变反应条件,达平衡时鼓风炉中反应③CO的转化率为80%,此时该反应的平衡常数K= 0.352 ,此时焙烧炉和鼓风炉消耗的O2的体积比大于 12:5 或2.4 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com