
【题目】用CaSO4代替O2与燃料CO反应,既可以提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①1/4CaSO4(s)+CO(g)![]() 1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
②CaSO4(s)+CO(g)![]() CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
③CO(g)![]() 1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
反应①~③的平衡常数的对数lgK随反应温度T的变化曲线见图,结合各反应的△H,归纳lgK~T曲线变化规律:
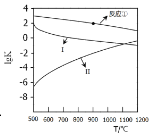
a)___;b)___。
科目:高中化学 来源: 题型:
【题目】Ⅰ.尿素[CO(NH2)2]是人工合成的第一种有机物。
(1)尿素中所含元素的电负性最大的是______,尿素分子间的氢键可表示为______。
(1)尿素可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3。
①与铁同周期且未成对电子数与Fe3+相同的元素是______。
②[Fe(H2NCONH2)6](NO3)3中存在的化学键______![]() 填序号
填序号![]() 。
。
A.离子键B.金属键C.配位键D.σ键E.π键
③![]() 中N原子杂化后的价电子排布图为______,
中N原子杂化后的价电子排布图为______,![]() 的空间构型为______。
的空间构型为______。
Ⅱ.Mg2NiH4是一种贮氢的金属氢化物
(3) Mg2NiH4可通过氢化镁和镍单质球磨制成。在Mg2NiH4晶胞中,Ni原子占据如图的顶点和面心, Mg2+处于如图八个小立方体的体心。
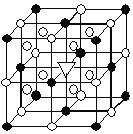
①Mg2NiH4中H的化合价为______。
②Mg2+位于Ni原子形成的______ (填“八面体空隙”或“四面体空隙”)。
③若晶体的密度为d g·cm-3,Mg2NiH4的摩尔质量为M g·mol-1,则Mg2+和Ni原子的最短距离为______nm(用含d、M的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:

(1)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中![]() 的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___。
的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___。
(2)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___、___;590℃之后,丁烯产率快速降低的主要原因可能是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香酯I的合成路线如下:
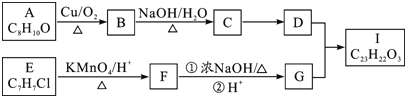
已知以下信息:
①A-I均为芳香族化合物,B能发生银镜反应,D的相对分子质量比C大4,E的苯环上的一溴代物有两种。
②![]()
③2RCH2CHO![]()
请回答下列问题:
(1)C→D的反应类型为___,E的名称为___。
(2)E→F与F→G的顺序能否颠倒___(填“能”或“否”),理由___。
(3)B与银氨溶液反应的化学方程式为___。
(4)I的结构简式为___。
(5)符合下列要求A的同分异构体还有___种。
①与Na反应并产生H2 ②芳香族化合物
其中核磁共振氢谱为4组峰,且面积比为6:2:1:1的是___(写出其中一种的结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的块状的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如右图所示,分析判断:______段化学反应速率最快,_______段收集的二氧化碳气体最多。
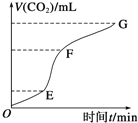
(2)上述反应中,A g块状碳酸钙跟足量盐酸反应,反应物消耗的质量随时间的变化曲线由实线表示,在相同的条件下,将B g(A>B)粉末状碳酸钙与足量的同浓度盐酸反应,反应物消耗的质量随时间的变化曲线由虚线表示。则最符合实际情况的图像是________。

(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是_________。
A.蒸馏水 B.氯化钠 C.硝酸钾溶液 D.浓盐酸 E.降温 F加入MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=___。已知:K300℃>K350℃,则该反应是___热反应。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是___
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5,表示,咸水中的主要溶质为NaCl。下列有关说法正确的是

A. a为原电池的负极
B. b电极附近溶液的pH减小
C. a电极反应式为![]()
D. 中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2FeSO4·7H2O ![]() Fe2O3+SO2↑+SO3↑+14H2O↑。用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是
Fe2O3+SO2↑+SO3↑+14H2O↑。用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是

A. 乙、丙、丁中可依改盛装无水CuSO4、Ba(NO3)2溶液、品红溶液
B. 实验时应先打开K,缓缓通入N2,再点燃酒精喷灯
C. 甲中残留固体加稀硫酸溶解,再滴加KSCN,溶液变红
D. 还应在丁装置后面连接盛有NaOH溶液的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)![]() 2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
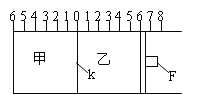
(1)可根据__________现象来判断甲、乙都已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是____________。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为_____mol,乙中C的转化率________50%(填:>、<、=),此时,乙中可移动活塞F最终停留在右侧刻度________处(填下列序号:① <6 ② >6 ③ =6)
(Ⅱ)若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(1)测得甲中A的转化率为b,则乙中C的转化率为_________;
(2)假设乙、甲两容器中的压强比用d表示,则d的取值范围是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com