
【题目】1.4 克 CO 在标准状况下的体积是____L,与____克 CO2 所含有的分子数相同。
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
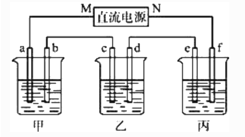
接通电源,经过一段时间后,测得丙中K2SO4的质量分数变为10.47%,乙中c电极质量增加。
①电源的N端为________极;
②电极b上发生的电极反应式为___________________________________________;
③电极b上生成的气体在标准状况下的体积___________L;
④电极c的质量变化是________g;
⑤电解前后溶液的pH保持不变的是________。
A.甲溶液 B.乙溶液 C.丙溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2X(g)+Y(g) ![]() 2Z(g)。某研究小组将4 mol X和2 mol Y置于一容积不变的密闭容器中,测定不同时间段内X的转化率,得到如下表数据:
2Z(g)。某研究小组将4 mol X和2 mol Y置于一容积不变的密闭容器中,测定不同时间段内X的转化率,得到如下表数据:
t(min) | 2 | 4.5 | 5 | 6 |
X转化率 | 30% | 40% | 70% | 70% |
根据以上信息作出的下列判断中正确的是( )
A. 随着反应的进行,混合气体的密度不断增大
B. 反应在5.5 min时,v正(X)=v逆(Z)
C. 6 min时,容器中剩余1.4 mol Y
D. 其他条件不变,将X的物质的量改为10 mol,则可得4 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学反应 3Cu+8HNO3→3Cu(NO3)2+2NO↑+4H2O 中,硝酸中被还原和未被还原的氮元素的质量比是
A. 3:1 B. 1:1 C. 1:2 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图,有下列说法:

①若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
②若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
③若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸
④若四种元素只有一种为金属,则Z与Y的最高价氧化物对应的水化物一定为强酸。
其中正确的说法有几项( )
A. 1项 B. 2项 C. 3项 D. 4项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油化工生产中,利用裂解反应可以获得重要化工原料乙烯、丙烯。一定条件下,正丁烷裂解的主反应如下:
反应I C4H10(g)![]() CH4(g)+CH3CH-CH3(g) △H1;
CH4(g)+CH3CH-CH3(g) △H1;
反应Ⅱ C4H10(g)![]() C2H6(g)+CH2=CH2(g) △H2;
C2H6(g)+CH2=CH2(g) △H2;
回答下列问题:
(1)正丁烷、乙烷和乙烯的燃烧热分别为Q1kJ·mol-1、Q2kJ·mol-1、Q3kJ·mol-1,反应Ⅱ的△H2=______________。
(2)一定温度下,向容积为5L的密闭容器中通入正丁烷,反应时间(t)与容器内气体总压强(p)数据如下:
t/min | 0 | a | 2a | 3a | 4a |
p/MPa | 5 | 7.2 | 8.4 | 8.8 | 8.8 |
①该温度下,正丁烷的平衡转化率a=__________;反应速率可以用单位时间内分压的变化表示,即v=![]() ,前2a min内正丁烷的平均反应速率
,前2a min内正丁烷的平均反应速率![]() =__________MPa·min-1。
=__________MPa·min-1。
②若平衡时甲烷、乙烯的体积分数分别为![]() 、
、![]() ,则该温度下反应I的压力平衡常数Kp=_________MPa(用平衡分压代替平衡浓度计算,分压一总压×物质的量分数,保留三位有效数字)。
,则该温度下反应I的压力平衡常数Kp=_________MPa(用平衡分压代替平衡浓度计算,分压一总压×物质的量分数,保留三位有效数字)。
③若反应在恒温、恒压条件进行,平衡后反应容器的体积_________8.8L(填“>”“<”或“=”)。
④实际生产中发现高于640K后,乙烯和丙烯的产率随温度升高增加幅度减小,可能的原因是__________(任写1条)。
(3)一种丁烷燃料电池工作原理如图所示。

①A电极上发生的是反应_________(填“氧化“或“还原”)。
②写出B电极的电极反应式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与阿伏加德罗常数的值( NA)有关的说法正确的是
A. 在标准状况下,2.24L水中含有氢原子的数目为2NA
B. 8.0 g Cu2S和CuO的混合物中含有铜原子数为0.1NA
C. 在密闭容器中加入0.5 mol N2和1.5 mol H2,充分反应后可得到NH3分子数为NA
D. 2.3 g Na与氧气完全反应,反应中转移的电子数在0.1NA~0.2NA之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有mA(s)+nB(g)qC(g) △H<0的可逆反应,在一定温度下达平衡时,B的体积分数ф(B)和压强p的关系如图所示,则下列有关该反应的描述正确的是( )

A. m+n<qB. n>q
C. x点的混合物中v (正)<v (逆)D. x点比y点的混合物的正反应速率小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个电化学过程的示意图,请回答下列问题:

(1)图中甲池是_________ (填“原电池” “电解池”或“电镀池”)。
(2)A(石墨)电极的名称是_________ (填“正极” “负极” “阴极”或“阳极”)
(3)写出通入CH3OH的电极的电极反应式________________
(4)乙池中反应的化学方程式为__________________。当乙池中B(Ag)极质量增加54g,甲池中理论上消耗O2的体积为____L(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com