
����Ŀ��һ�������̿�(��Ҫ�ɷ�ΪMnO2��SiO2��Al2O3)�ͻ�����(FeS2��SiO2)Ϊԭ��ұ�������̵Ĺ���������ͼ��ʾ��
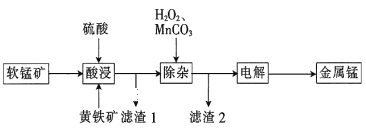
��֪��ؽ�������[c(Mn+)=0.1molL-1]�γ��������������pH���£�
�������� | Fe3+ | Mn2+ | Al3+ |
��ʼ������pH | 2.7 | 8.3 | 3.2 |
������ȫ��pH | 3.7 | 9.8 | 5.0 |
�ش��������⣺
��1��MnO2���������������ᣬ������Fe2+��������ȴ���ܽ⣬д���÷�Ӧ�����ӷ���ʽ��___��
��2������1�ijɷֳ���SiO2�⣬����һ�ֵ���ɫ��������___(�ѧʽ)��
��3�����Ӳ����м����MnCO3��������___���ù����������ҺpH�ķ�Χ��___������pH���ù��ߣ����˻�ʹ�̵IJ��ʻή�ͣ���������___��
��4���ö��Ե缫���е�⣬���տ�ʼʱ�����ĵ缫��ӦʽΪ___�����������ĵ������Һ�ɷ���___(��������������������������)�������ʹ�á�
���𰸡�MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O S ������Һ��pH��ʹFe3+��Al3+��ȫ���� 5.0��pH��8.3 ��ʹAlԪ���γ�AlO2-������Һ�ж���������� Mn2++2e-=Mn ���
��������
�������У��������ܽ����̿�ͻ�����Al2O3��FeS2�ܽ����Al3+��Fe2+��MnO2��SiO2���ܽ⣬�����⣨1����2����֪��MnO2��Fe2+��S22-�������з���������ԭ��Ӧ����Mn2+��Fe3+��S��ʹMnO2Ҳ�ܽ�����Һ�У���������I����Ҫ�ɷ���SiO2��S��������Һ�к���Al3+��Mn2+��Fe2+��Fe3+��Ȼ������Һ�м���H2O2��Ŀ����Ϊ�˽�Fe2+ȫ��ת��ΪFe3+���ټ���MnCO3���Ե�����ҺpH��5.0��pH��8.3��ʹ��Fe3+��Al3+��ȫ�����������Ϳ��Ի�ô�����MnSO4��Һ����������2����Ҫ�ɷ���Fe(OH)3��Al(OH)3���ٵ�����õ�MnSO4��Һ���ɵõ�����Mn��
��1��MnO2����ǿ�����ԣ�Fe2+���л�ԭ�ԣ������������з���������ԭ��Ӧ:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O��
��2��FeS2��S��-1�ۣ�Ҳ���н�ǿ�Ļ�ԭ�ԣ����Ա�MnO2����ΪS���������Ѿ���֪����1����SiO2֮�⣬�����е���ɫ���ʣ���ֻ��S�������⣻
��3�����Ӳ����м����MnCO3��������ʹFe3+��Al3+��ȫ���������ݱ����ṩ����Ϣ��֪����Ҫ����ҺpH���Ƶķ�ΧΪ5.0��pH��8.3������ҺpH���ߣ�Al(OH)3���γ�AlO2-���ܽ��Һ�У�ʹ�����õ�MnSO4��Һ�������ʣ������룻
��4�����ʱ���������ҺΪMnSO4��Һ��������ӦΪ��Mn2++2e-=Mn��������ӦΪ��2H2O-4e-=4H++O2�����ɴ˿��Կ������������Mn֮�⣬����H2SO4���ʵ��������ĵ������Һ�ɷ�������������ʹ�á�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���
A. ��NO2��N2O4��ɵ�ƽ����ϵ��ѹ����ɫ�ȱ�����dz
B. ����ѹǿ�ɼӿ�SO2ת��ΪSO3������
C. ����ɫ����ˮ���պ���ɫ��dz
D. �ں���Fe(SCN)3�ĺ�ɫ��Һ�м����ۣ����ã���Һ��ɫ��dz����ȥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ����������Ķ��ε�أ����ĵ���ܷ�ӦʽΪ��Pb + PbO2 + 4H++ 2SO42�� ![]() 2PbSO4+ 2H2O������˵����ȷ����
2PbSO4+ 2H2O������˵����ȷ����
A.���ʱ��������ӦΪ��Pb��2e��+ SO42��= PbSO4
B.�ŵ�ʱ����·��ͨ��2mol���ӣ����������207g
C.�ŵ������ҪʹǦ���ظ�ԭ��Pb�缫Ӧ�����Դ��������
D.��Ǧ���ص�⾫����ͭ����ͭӦ��PbO2�ĵ缫���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.��ϵͳ��������![]() ������Ϊ2��7��7-����-3-�һ�����
������Ϊ2��7��7-����-3-�һ�����
B.�ѻ�������һ�����õ��л��ܼ�������������ϴ�������պ���ȡ��ˮ�е�±��
C.DDT�Ľṹ��ʽΪ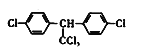 �������������13��̼ԭ�ӹ�ƽ��
�������������13��̼ԭ�ӹ�ƽ��
D.![]() �ĵ�����CH3-C��C-CH3��CH2=CH-CN
�ĵ�����CH3-C��C-CH3��CH2=CH-CN
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ1.00L�������У�ͨ��һ������N2O4��������ӦN2O4 (g)![]() 2NO2 (g)��H�����¶����ߣ�����������ɫ����ش��������⣺
2NO2 (g)��H�����¶����ߣ�����������ɫ����ش��������⣺
��1����Ӧ����H ___0����������������������100��ʱ����ϵ�и�����Ũ����ʱ��仯��ͼ��ʾ����0~60sʱ�Σ���Ӧ����v(N2O4)Ϊ___________molL��1s��1����Ӧ��ƽ�ⳣ��KΪ_______molL��1��
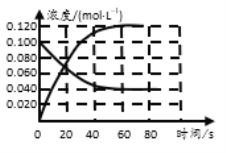
��2��100��ʱ�����ݻ�Ϊ1.00L�������У�ͨ��1mol NO2(g)��1mol N2O4(g)����ʱv��_______ v������������������������=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���N(![]() )��һ�ֳ������л��ϳ��м��壬����������;�㷺��
)��һ�ֳ������л��ϳ��м��壬����������;�㷺��
�л���AΪԭ�Ϻϳ�M��N��·��������ʾ��

��֪��I.R-CH=CH2+HBr ![]() R-CH2CH2Br
R-CH2CH2Br
II.R-CH2-CN![]() R-CH2-COOH
R-CH2-COOH ![]()
![]()
��ش��������⣺
(1)A�����й����ԭ�������Ϊ___________������CN�ĵ���ʽΪ___________��
(2)�ڵķ�Ӧ����Ϊ___________��E���������������ŵ�����Ϊ___________��G�Ľṹ��ʽΪ______________________��
(3)д����Ӧ�ݵĻ�ѧ����ʽ__________________________��
(4)д��M������������ˮ��Ļ�ѧ����ʽ______________________��
(5)D��ͬ���칹���У��ܷ���������Ӧ���������Ʒ�Ӧ�ų�H2�Ĺ���___________�֣�д���˴Ź���������4��壬�ҷ������Ϊ1��1��2��6��һ��ͬ���칹��Ľṹ��ʽ��___________��
(6)�����Ϣ��д����E���Ҵ�Ϊԭ���Ʊ�������N�ĺϳ�·�ߣ�(�����Լ���ѡ)___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�Ȼ�ѧ����ʽ2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=a kJ/mol��T Kʱ����2 L�����ܱ������г���2mol NO ��2mol CO�������¶Ȳ��䣬5 min��Ӧ�ﵽƽ��״̬����ʱc(N2)=0.4mol/L������˵���д������
N2(g)+2CO2(g) ��H=a kJ/mol��T Kʱ����2 L�����ܱ������г���2mol NO ��2mol CO�������¶Ȳ��䣬5 min��Ӧ�ﵽƽ��״̬����ʱc(N2)=0.4mol/L������˵���д������
A.���÷�Ӧ�Ƿ��ȷ�Ӧ����a<0
B.��NO��ʾ��ƽ����ѧ��Ӧ����v(NO)Ϊ0.16mol/(L��min)
C.�ﵽ��ѧƽ��ʱ��CO��ת������80%
D.�����¶Ȳ��䣬�����������ﵽƽ�����ϵ�г���2mol NO ��2mol CO����Ӧ���´ﵽƽ��ʱc(N2)����0.8mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ijͬѧ�������백ˮ�������ϣ����ǰ������Һ��Ũ�Ⱥͻ�Ϻ�������Һ��pH���±����ݱ�����������˵����ȷ���ǣ� ��
ʵ���� | ��ˮŨ��/mol��L��1 | ����Ũ��/mol��L��1 | �����ҺpH |
�� | 0.1 | 0.1 | pH��5 |
�� | c | 0.2 | pH��7 |
�� | 0.2 | 0.1 | pH��7 |
A.����c��0.2
B.�١���������Һ�е�![]() ����>��
����>��
C.����������Һ��c(NH4+)+c(H+)��c(OH��)+c(NH3��H2O��
D.�������û����Һ����ˮ�������c(H��)��1��10��9 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(Fe3O4)�����������ȶ���������������;�㷺�����ٴ���ϡ����\���ͻ�����ѧ�������DZ��Ӧ�õ��������ߡ�ˮ�ȷ��Ʊ�Fe3O4�������ķ�Ӧ��3Fe2����2S2O![]() ��O2��xOH��=Fe3O4����S4O
��O2��xOH��=Fe3O4����S4O![]() ��2H2O����ش��������⡣
��2H2O����ش��������⡣
��1��ˮ�ȷ��Ʊ�Fe3O4�������ķ�Ӧ�У���ԭ����____________��
��2����Ӧ�Ļ�ѧ����ʽ��x��________��
��3��ÿ����1 mol Fe3O4����Ӧת�Ƶĵ���Ϊ________mol����Fe2����ԭ��O2�����ʵ���Ϊ________mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com