
【题目】铅蓄电池是最常见的二次电池,它的电池总反应式为:Pb + PbO2 + 4H++ 2SO42- ![]() 2PbSO4+ 2H2O。下列说法正确的是
2PbSO4+ 2H2O。下列说法正确的是
A.充电时,阳极反应为:Pb-2e-+ SO42-= PbSO4
B.放电时,电路中通过2mol电子,负极板减轻207g
C.放电结束后,要使铅蓄电池复原,Pb电极应与外电源正极连接
D.用铅蓄电池电解精炼粗铜,粗铜应与PbO2的电极相接
科目:高中化学 来源: 题型:
【题目】醇和酚在人类生产和生活中扮演着重要的角色,根据醇和酚的概念和性质回答下列问题。
(1)下列物质属于酚类的是__________。写出⑤发生消去反应的化学方程式(注明反应条件)____。
①CH3CH2CH2OH②CH3CH(OH)CH3③CH2=CH-CH2OH④CH2OH-CH2OH⑤ ⑥
⑥ ⑦
⑦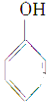
(2)司机酒后驾车时可检测他呼出的气体,所利用的化学反应如下:2CrO3(红色)+3C2H5OH+3H2SO4===Cr2(SO4)3(绿色)+3CH3CHO+6H2O被检测的气体成分是__________,上述反应中的氧化剂是____________,还原剂是____________。
(3)300多年前,著名化学家波义耳发现了铁盐与没食子酸的显色反应,并由此发明了蓝黑墨水。没食子酸的结构简式如图,写出没食子酸中含有的官能团名称_____________用没食子酸制造墨水主要利用了__________类化合物的性质(填代号)。

A.醇 B.酚 C.油脂 D.羧酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.将Cl2通入热的NaOH溶液:Cl2+6OH-![]() Cl-+ClO3-+3H2O
Cl-+ClO3-+3H2O
B.用醋酸除水垢:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑
C.酸性FeSO4溶液长期放置发生变质:4Fe2++O2+4H+=4Fe3++2H2O
D.向NH4HCO3溶液中加入过量NaOH溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作和过程可以达到实验目的的是
选项 | 实验目的 | 实验操作和过程 |
A | 取20.00 mL盐酸 | 在50mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸全部放入锥形瓶 |
B | 探究浓度对反应速率的影响 | 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象 |
C | 探究铁的吸氧腐蚀 | 将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中
|
D | 证明 Ksp(CuS)<Ksp(ZnS) | 向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液,生成黑色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置进行有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整_________。
(2)实验中他们取6.4 g铜片和12 mL 18 mol·L1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①写出铜跟浓硫酸反应的化学方程式:__________________;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是__________________;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是________(填编号)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)装置C中试管D内盛装的是品红溶液,当B中气体收集满后,有可能观察到的现象是_____________,待反应结束后,向C中烧杯内加入沸水,D中观察到的现象是_____________。
(4)实验装置C有可能造成环境污染,试用最简单的方法加以解决,__________________(实验用品自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙叉环丙烷(n)由于其特殊的结构,一直受到结构和理论化学家的关注,它有如下转化关系。下列说法正确的是
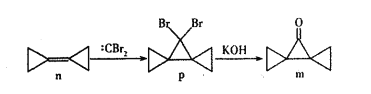
A. n分子中所有原子都在同一个平面上
B. n和:CBr2生成p的反应属于加成反应
C. p分子中极性键和非极性键数目之比为2:9
D. m分子同分异构体中属于芳香族化合物的共有四种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以软锰矿(主要成分为MnO2、SiO2、Al2O3)和黄铁矿(FeS2、SiO2)为原料冶炼金属锰的工艺流程如图所示:
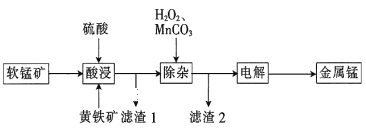
已知相关金属离子[c(Mn+)=0.1molL-1]形成氢氧化物沉淀的pH如下:
金属离子 | Fe3+ | Mn2+ | Al3+ |
开始沉淀的pH | 2.7 | 8.3 | 3.2 |
沉淀完全的pH | 3.7 | 9.8 | 5.0 |
回答下列问题:
(1)MnO2本身不能溶于硫酸,但是在Fe2+的作用下却能溶解,写出该反应的离子方程式:___。
(2)滤渣1的成分除了SiO2外,还有一种淡黄色的物质是___(填化学式)。
(3)除杂步骤中加入的MnCO3的作用是___,该过程需调节溶液pH的范围是___,若把pH调得过高,除了会使锰的产率会降低,其后果还有___。
(4)用惰性电极进行电解,电解刚开始时阴极的电极反应式为___,电解后阳极的电解质溶液可返回___(填“酸浸”“除杂”或“电解”)工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1mol·L-1的下列4种溶液:
①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
HCN | H2CO3 | CH3COOH |
Ka=4.9×10-10 | Ka1=4×10-7;Ka2=5.6×10-11 | Ka=1.7×10-5 |
(1)①中各离子浓度由大到小的顺序是___。
(2)④的水解平衡常数Kh=___。
(3)若向等体积的③和④中滴加盐酸至呈中性,则消耗盐酸的体积③___④(填“>”、“<"、“=”)
(4)向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com