
【题目】按要求填空。
(1)3.01×1023个CO2分子中含______mol氧原子,在标准状况下其体积为____L,0.4 molOH-的中有______个电子。
(2)某金属氯化物MClx的摩尔质量为133.5g/mol,取该金属氯化物26.7g配成水溶液,与足量AgNO3溶液完全反应,生成86.1g白色沉淀。则金属M的摩尔质量为________。
(3)同温同压下,等质量的N2和CO2所含分子数比为_____,体积比为________。
(4)某气体在标准状况下的密度为1.25g/L,则28g该气体所含有的分子数为________。
(5)用98%的浓硫酸(ρ=1.84 g/cm3)配制1 mol/L的稀硫酸l00mL,配制过程中需量取浓硫酸____mL。
【答案】111.24NA或2.408×102427g/mol 11:711:7NA (或 6.02×1023)5.4
【解析】
(1)3.01×1023个CO2的物质的量为0.5mol,含1mol氧原子,在标准状况下CO2气体的体积为0.5×22.4=11.2 L;OH-有10个电子 ,0.4 mol OH-的中有4NA(或2.408×1024)个电子;综上所述,本题答案是:1 ,11.2,4NA或2.408×1024。
(2)金属氯化物26.7g配成水溶液,与足量AgNO3溶液完全反应,生成86.1g即86.1/143.5=0.6molAgCl白色沉淀,所以氯离子的物质的量是0.6mol,金属氯化物MClx的摩尔质量为133.5g/mol,该金属氯化物质量是26.7g,根据氯离子守恒,则26.7x/133.5=0.6,计算得出x=3,所以金属M的摩尔质量为133.5g/mol-(35.5g/mol×3)=27g/mol;因此,本题正确答案是:27g/mol;
(3)设质量均为m,等质量的N2和CO2所含分子数比为m/28:m/44=11:7,同温同压下,体积比等于物质的量比,则体积比为11:7;因此,本题正确答案是: 11:7,11:7。
(4)某气体在标准状况下的密度为1.25g/L,该气体的摩尔质量为:M=Vmρ=1.25×22.4=28g/mol,28g该气体的物质的量为:28/28=1mol,所以28g 该气体所含有的分子数为NA (或 6.02×1023);因此,本题正确答案是: NA (或 6.02×1023)。
(5)根据公式c=![]() =1000×98%×1.84/98=18.4mol/L,根据稀释前后溶质的量保持不变,18.4×V=1×0.1,V=0.0054L=5.4 mL;综上所述,本题答案是:5.4。
=1000×98%×1.84/98=18.4mol/L,根据稀释前后溶质的量保持不变,18.4×V=1×0.1,V=0.0054L=5.4 mL;综上所述,本题答案是:5.4。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】下列方程式中,正确的是
A. 0.01mol·L-1NH4Al(SO4)2溶液与0.02mol·L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
B. 甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH﹣![]() HCOO﹣+NH4++2Ag↓+3NH3+H2O
HCOO﹣+NH4++2Ag↓+3NH3+H2O
C. 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+==AgBr↓
D. 苯酚钠溶液中通入少量CO2:2C6H5O﹣+CO2+H2O→2C6H5OH+CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有( )
A.1对
B.2对
C.3对
D.4对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量CaCl2、MgCl2、FeCl3、Na2SO4等杂质离子,实验室提纯NaCl的流程如下:
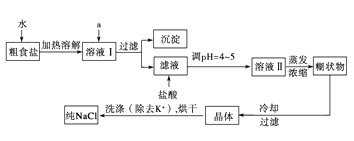
(1)加入A试剂,是为了除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42﹣离子。A代表的是多种试剂,按滴加顺序依次为:i NaOH,ii_________,iii___________(填化学式)。
(2)请写出下列试剂加入试剂i时发生主要反应的化学反应方程式:___________________。
(3)下图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。

a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(4)操作Ⅲ的名称是_________________________。
(5)m g粗盐提纯后得到n g纯净的NaCl固体,则m与n的大小关系为______。
A.m>n B.m<n C.m=n D.无法确定.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一碳化学”是指以含一个碳原子的化合物(如:CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)=NH2COONH4(s)△H1
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)==CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol
请回答下列问题:
①反应I的△H1=______ kJ/mol
②反应II一般在_________(填“高温”或“低温”)情况下有利于该反应的进行。
③一定温度下,在体积为固定的密闭容器中按计量比进行反应I,下列能说明反应达到了平衡状态的是__________(填序号)。
A.混合气体的平均相对分子质量不再变化 B.容器内气体总压强不再变化
C.2V正(NH3)=V逆(CO2) D.容器内混合气体的密度不再变化
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应是否建立平衡状态? ___________(填“是”或“否”)
(2)将CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
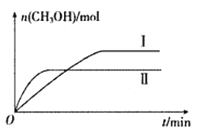
①曲线I.II对应的平衡常数大小关系为KI_______KII(填“ >”、“<”或“=”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | amolCO2、bmolH2 cmol CH3OH(g)、cmolH2O(g)(a、b、c均不为零) |
若甲容器平衡后气体的压强为开始的0.8倍,则甲容器平衡混合气体中CH3OH(g)的体积分数为_______,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,乙容器中c的取值范围为________。
(3)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如下图,乙酸的生成速率主要取决于温度影响的范围是________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们通过电视画面经常可以看到在奥运会等各种激烈的比赛过程中,当运动员肌肉挫伤或扭伤时,医生随即对运动员的伤部喷射一种液体药剂来急救。该液体药剂为氯乙烷(沸点12.27 ℃),可进行局部冷冻麻醉的应急处理。

完成下列问题:
(1)制取氯乙烷(CH3CH2Cl)的最好的方法是_______________(填序号)。
A.乙烷与氯气反应 B.乙烯与氯气反应
C.乙烷与氯化氢反应 D.乙烯与氯化氢反应
(2)写出所选反应的化学方程式:_______________。该反应的反应类型为_______________。
(3)氯乙烷能用于冷冻麻醉应急处理的理由是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A. 金属元素和非金属元素一定形成离子化合物
B. 共价化合物中只有共价键,一定没有离子键
C. 含有金属阳离子的晶体未必是离子晶体
D. 离子化合物中可能含有极性共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com