
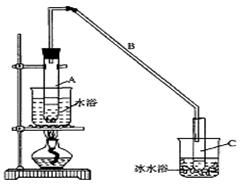
1,2����������������Ϳ����������Ӽ���������������ɫҺ�壬�ܶ���2��18g/cm3���е�131��4�棬�۵�9��79�棬������ˮ�������ڴ����ѡ���ͪ���л��ܼ�����ʵ�����п�������ͼ��ʾװ���Ʊ�1,2-�������顣���з�Һ©������ƿa��װ���Ҵ���Ũ����Ļ��Һ���Թ�d��װ��Һ��(���渲������ˮ)��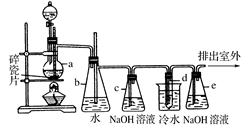
(1)д���������Ʊ�1,2-���������������ѧ��Ӧ����ʽ_____________________________��
(2)��ȫƿb���Է�ֹ�����������Լ��ʵ�����ʱ�Թ�d�Ƿ�����������д����������ʱƿb�е�����________________________________________��
(3)����c��NaOH��Һ�������ǣ� ��
(4)ijѧ������ʵ��ʱ��ʹ��һ������Һ�壬����ȫ����ɫʱ���������Ҵ���Ũ������Һ��������������³������࣬���װ�õ�������û�����⣬�Է�������ܵ�ԭ�� ��
(1) CH3CH2OH  CH2=CH2����H2O�� CH2=CH2��Br2 �� CH2BrCH2Br��
CH2=CH2����H2O�� CH2=CH2��Br2 �� CH2BrCH2Br��
(2)b��ˮ����½����������е�ˮ������������������
(3)��ȥ��ϩ�д�������������(�������̼����������)��
(4)����ϩ����(��ͨ��Һ��)�ٶȹ��죬��ʵ������У���ϩ��Ũ����Ļ��Һû��Ѹ�ٴﵽ170��(��д�����²�����Ҳ����)
���������������1�����Ҵ���Ũ�����ϼ��ȷ�����ȥ��Ӧ�õ���ϩ��ˮ��Ȼ�����ϩͨ�뵽��ˮ�У������ӳɷ�Ӧ�õ�1,2-�������顣��Ӧ��������ѧ��Ӧ����ʽΪ��CH3CH2OH  CH2=CH2����H2O�� CH2=CH2��Br2 �� CH2BrCH2Br��(2)��ȫƿb���Է�ֹ�����������Լ��ʵ�����ʱ�Թ�d�Ƿ�����������d��������,���ڲ��������岻�ܼ�ʱ�ų���ʹװ���е�����ѹǿ����ƿbˮ����½����������е�ˮ����������������������(3)����c��NaOH��Һ�������dz�ȥ��ϩ�д�������������(�������̼����������)����ֹ��Ⱦ��������ɻ�����Ⱦ��(4)ijѧ������ʵ��ʱ��ʹ��һ������Һ�壬����ȫ����ɫʱ���������Ҵ���Ũ������Һ��������������³������࣬��װ�õ�������û�����⣬��������ϩ����(��ͨ��Һ��)�ٶȹ��죬δ���ü����վʹ���ˮ��ͨ����Ҳ�����Ƿ�Ӧ��ȡ��ϩʱ�¶�û��Ѹ�ٴﵽ170��(��д�����²�����Ҳ����)��������ȡ����Ӧ�õ����Ѷ���ɡ�
CH2=CH2����H2O�� CH2=CH2��Br2 �� CH2BrCH2Br��(2)��ȫƿb���Է�ֹ�����������Լ��ʵ�����ʱ�Թ�d�Ƿ�����������d��������,���ڲ��������岻�ܼ�ʱ�ų���ʹװ���е�����ѹǿ����ƿbˮ����½����������е�ˮ����������������������(3)����c��NaOH��Һ�������dz�ȥ��ϩ�д�������������(�������̼����������)����ֹ��Ⱦ��������ɻ�����Ⱦ��(4)ijѧ������ʵ��ʱ��ʹ��һ������Һ�壬����ȫ����ɫʱ���������Ҵ���Ũ������Һ��������������³������࣬��װ�õ�������û�����⣬��������ϩ����(��ͨ��Һ��)�ٶȹ��죬δ���ü����վʹ���ˮ��ͨ����Ҳ�����Ƿ�Ӧ��ȡ��ϩʱ�¶�û��Ѹ�ٴﵽ170��(��д�����²�����Ҳ����)��������ȡ����Ӧ�õ����Ѷ���ɡ�
���㣺�������ʵ���ȡ��������ʵ������е�ʵ������ķ�����ԭ��ʹ������������ֵ�в����ԭ��


 53���ò�ϵ�д�
53���ò�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��пʪ��ұ�������У����������ͭ��������Ҫ����Zn��Cd��Fe��Cu�ȣ���ֱ�Ӷ�������ɻ�����Ⱦ��Ҳ����Դ�˷ѣ�����Ϊ���մ���ͭ�����Ʊ�����п����Ĺ�ҵ���̣�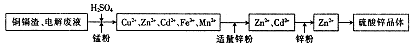
��֪������п����������ˮ�������ھƾ���
��1�����������Ŀ�� ��
��2��������ܳ�ͭ�������̷���Ϊ�˽�������ӵı�������ݵ��ӣ���ͭ�ܳ����̷۵���Ҫ�ɷ�ΪMnO2����ط���ʽΪ2Fe3++Cu=2Fe2++Cu2+�� ��
��3��������п��Һ�������п���壬��Ҫ�IJ�������Ϊ ��
��4���Ƶõ�����п������Ҫϴ�ӣ�ѡ����Լ�Ϊ ��ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
��17�֣���2012?�㶫��������㷺Ӧ������ҩ�ͻ�����ҵ��ijͬѧ�����üױ���������Ӧ�Ʊ������ᣬ��Ӧԭ����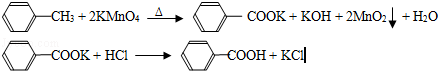
ʵ�鷽����һ�����ļױ���KMnO4��Һ��100�淴Ӧһ��ʱ���ֹͣ��Ӧ�����������̷����������ͻ���δ��Ӧ�ļױ���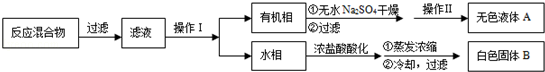
��֪�������������122���۵�122.4�棬��25���95��ʱ�ܽ�ȷֱ�Ϊ0.3g��6.9g�����������л��ﶼ�й̶��۵㣮
��1���������� ������������ ����
��2����ɫҺ��A���� �������Լ���A���Լ����� ������������
��3���ⶨ��ɫ����B���۵㣬��������115�濪ʼ�ۻ����ﵽ130��ʱ�����������ۣ���ͬѧ�Ʋ��ɫ����B�DZ�������KCl�Ļ�����������·��������ᴿ�ͼ��飬ʵ���������Ʋ���ȷ�����ڴ������ɱ������ݣ�
| ��� | ʵ�鷽�� | ʵ������ | ���� |
| �� | ����ɫ����B����ˮ�У������ܽ⣬��_________�� ��_________�� | �õ���ɫ�������ɫ��Һ | |
| �� | ȡ������Һ���Թ��У���_________�� | ���ɰ�ɫ���� | ��Һ��Cl�� |
| �� | �����ɫ���壬��_________�� | ��_________�� | ��ɫ�����DZ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
ij��ѧС���������������������װ�ã���ͼ�����Ի�����Ϊ��Ҫԭ���Ʊ�����ϩ��
(1)�Ʊ���Ʒ
��12.5 mL�����������Թ�A�У��ټ���l mLŨ���ᣬҡ�Ⱥ�������Ƭ��������������Ӧ��ȫ�����Թ�C�ڵõ�����ϩ��Ʒ��
��A�����Ƭ��������____________������B���˵�������е�������____________��
���Թ�C���ڱ�ˮԡ�е�Ŀ����______________________________��
(2)�Ʊ���Ʒ
�ٻ���ϩ��Ʒ�к��л������������������ʵȡ����뱥��ʳ��ˮ�������á��ֲ㣬����ϩ��_________��(���ϻ���)����Һ����_________ (������)ϴ�ӡ�
a��KMnO4��Һ b��ϡH2SO4 c��Na2CO3��Һ
���ٽ�����ϩ����ͼװ��������ȴˮ��_________�ڽ���(�g����f��)���ռ���Ʒʱ�����Ƶ��¶�Ӧ��_________���ң�ʵ���ƵõĻ���ϩ��Ʒ�����������۲��������ܵ�ԭ����________________________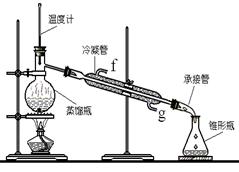
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
����ͭ���ȷֽ���������ͭ�����壬�����¶Ȳ�ͬ������ɷ�Ҳ��ͬ������ɷֿ��ܺ�SO2��SO3��O2�е�һ�֡����ֻ����֡�ij��ѧ����С��ͨ�����̽����ʵ�飬�ⶨ��Ӧ������SO2��SO3��O2�����ʵ�����������ȷ�������ʵĻ�ѧ���������Ӷ�ȷ��CuSO4�ֽ�Ļ�ѧ����ʽ��ʵ���õ�����������ͼ��ʾ��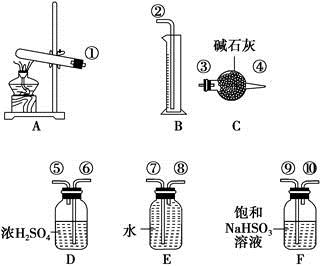
[�������]
��.��������ijɷֿ���ֻ��SO3һ�֣�
��.��������ijɷֿ��ܺ��� ���֣�
��.��������ijɷֿ��ܺ��� ���֡�
[ʵ��̽��]
ʵ����������ԡ���֪ʵ�����ʱ������ͭ��ȫ�ֽ⡣
(1)������װ̽��ʵ���װ�ã����������ҵķ��������ӿڵ�����˳��Ϊ�١��������ޡ��ݡ� �� �� �� ����(��ӿ����)��
(2)��ʵ�����ʱB����Ͳû���ռ���ˮ����֤������ ��ȷ��
(3)������ʵ��С����и�ʵ�飬���ڼ���ʱ���¶Ȳ�ͬ��ʵ����������������Ҳ��ͬ���������£�
| ʵ��С�� | ��ȡCuSO4������/g | װ��C���ӵ�����/g | ��Ͳ��ˮ���������ɱ�״������������/mL |
| һ | 6.4 | 2.56 | 448 |
| �� | 6.4 | 2.56 | 224 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
������ⷨ���Ѱ۲����ķ�Һ[���д���FeSO4��H2SO4������Fe2(SO4)3TiOSO4]���������������Ͳ�Ѫ�������������������������£�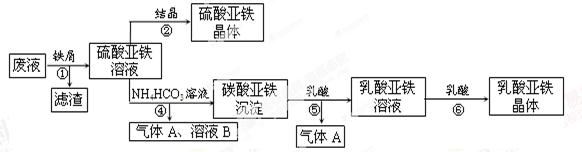
��ش�
��1��������з��������������______������ޱ������һ������նȣ�ԭ����_________��
��2����Һ�е�TiOSO4�ڲ������ˮ��������������Ҫ�ɷ�ΪTiO2?xH2O���Ļ�ѧ����ʽΪ__________������ܵ����ӷ���ʽΪ_____________________��
��3����ƽ���ƶ�ԭ�����Ͳ�����м������ܵõ�����������ԭ��_______��
��4����ƽ���Ը��������Һ������������Һ��Ӧ�����ӷ���ʽ��_____Fe2++_____MnO4��+_____H+=_____Fe3++_____Mn2++_____
ȡ��������þ�����Ʒag,����ϡ�������100.00 mL��Һ��ȡ��20. 00 mL��Һ,��KMnO4��Һ�ζ���������KMnO4����Ӧ����������0.1000 mol��L��1KMnO4��Һ20.00mL�������þ�����FeSO4?7H2O����������Ϊ���Ժ�a��ʽ�ӱ�ʾ��_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
������㷺Ӧ������ҩ�ͻ�����ҵ��ij��ȤС��ͬѧ���ø�����������ױ��Ʊ�������(KMnO4���������»�ԭ����ΪMnO2������������ΪMn2+)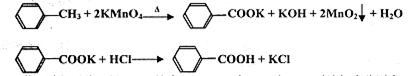
��֪����������Է�����122���۵�122.4�棬��25���95��ʱ�ܽ�ȷֱ�Ϊ0.3 g��6.9 go��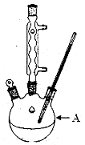
ʵ�����̣�
����װ��A�м���2.7mL (2.3 g)�ױ���125 mLˮ��Ȼ������μ���8.5 g�Թ�����KMnO4���壬���Ʒ�Ӧ�¶�Լ��100�棬���ױ��������ʧ���������ٳ�������ʱ��ֹͣ���ȡ�
�ڽ���Ӧ�������ȹ��ˣ���������ˮϴ���������ϲ���Һ��ϴ��Һ����ȴ�����Ũ���ᣬ������I�ð�ɫ�ϸ���ֲ�Ʒ��
�۴��Ȳⶨ����ȡ1.220g��ɫ��Ʒ�����100mL���״���Һ��ȡ25.00mL��Һ����0.1000mol/L KOH����Һ�ζ����ظ��ζ��ĴΣ�ÿ�����ĵ�������±���ʾ�о�
��ش�
��1��װ��A������ ���������¶ȼƣ���ʵ����Ʒ�Ӧ�¶ȵĴ�ʩΪ ��
��2����ɫ�ֲ�Ʒ�г���KCl�⣬�������ܵ�������Ϊ____ ��
��3������I������ ��
��4����������õ��Ķ��������� ��100mL����ƿ��50mL��ʽ����ʽ�ζ��ܡ�
��5����Ʒ�б����ᴿ��Ϊ ��
��6���ζ������У������װ��KOH����Һ�ĵζ��ܶ���ʱ���ζ�ǰ���ӣ��ζ�������ⶨ��� (�ƫ����ƫС�����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�����״�( )��һ����Ҫ�Ļ���ԭ�Ϻ�ҽҩ�м��壬ʵ���Һϳ������״���ϳ�������ͼ1��ʾ��װ����ͼ2��ʾ��
)��һ����Ҫ�Ļ���ԭ�Ϻ�ҽҩ�м��壬ʵ���Һϳ������״���ϳ�������ͼ1��ʾ��װ����ͼ2��ʾ��
��֪���������Լ�����ˮ�⣬ ����ʽ�廯þ����
����ʽ�廯þ����
����������ʵ������������£�
| ���� | �۵� | �е� | �ܽ��� |
| �����״� | 164.2�� | 380�� | ������ˮ�������Ҵ������ѵ��л��ܼ� |
| ���� | -116.3�� | 34.6�� | ����ˮ�������Ҵ��������л��ܼ� |
| �屽 | -30.7��C | 156.2��C | ������ˮ�������Ҵ������ѵȶ����л��ܼ� |
| ���������� | -34.6��C | 212.6��C | ������ˮ |
| Mg(OH)Br | ������Ϊ���� | ������ˮ�������ڴ����ѵ��л��ܼ� | |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�Ҷ���(H2C2O4)�׳Ʋ��ᣬ��һ����Ҫ�Ļ���ԭ�ϡ��������ϣ��˽�����й���Ϣ��
���Ҷ���������ˮ��������100�濪ʼ������125��ʱѸ��������157��ʱ������������ʼ�ֽ⡣�Ҷ������ȷֽ�����ˮ��������̼��һ�ֳ����Ļ�ԭ�����塣
���Ҷ���ĸ��Ρ����Ҷ����Ϊ������ˮ�İ�ɫ���塣ijУ��ѧ�о���ѧϰС��Ϊ̽������IJ������ʣ�����������ʵ�飺
��1��Ϊ�Ƚ���ͬŨ�ȵIJ��������ĵ����ԣ�ʵ����������100 mL 0.1mol/L�IJ�����Һ�����ƹ������õ��IJ�����������Ͳ���ձ�����������_____ ��____��
��2����ѧ��ȤС���ͬѧ��ʵ��֤���Ҷ��ᾧ�����ȷֽ����ɵ�����ɷ֡�����������ͼ�ṩ��װ�ã���ѡ�Լ������������ʵ�鷽������A��B��C��C��C��D��E˳�������������װ�ã������Ҷ��ᾧ�����ȷֽ����ɵ�����ɷ֡����㰴����װ�ô������ҵ�˳����д�±��еĿո�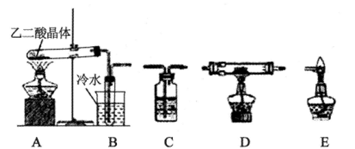
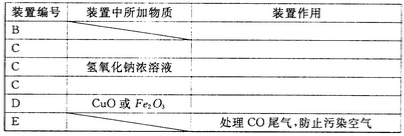
����д���Ҷ������ȷֽ�Ļ�ѧ����ʽ _______��
������ʵ������˵���Ҷ����ȷֽ������˻�ԭ�������ʵ��������____��
�ۼ����Ҷ�����н�ǿ�Ļ�ԭ�ԣ�ͨ��ѡ�õ��Լ���____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com