
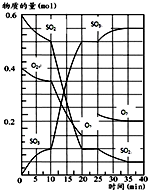
 500℃时,将SO2和O2置于一容积固定为2L的密闭容器中发生反应,反应过程中SO2、O2和SO3物质的量变化如图所示.
500℃时,将SO2和O2置于一容积固定为2L的密闭容器中发生反应,反应过程中SO2、O2和SO3物质的量变化如图所示.
| ||
| △t |
| ||
| △t |
| ||
| 5min |
| 1 |
| 2 |


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:
| A、中和热的测定和蒸馏均需要温度计,且温度计水银球均插入反应液中 |
| B、中和热的测定和过滤均需要玻璃棒,且玻璃棒的作用均是引流 |
| C、中和热的测定和中和滴定,均是将一种反应物逐滴滴加到另一种反应物中 |
| D、中和热的测定实验中用60mL 0.50mol?L-1盐酸和50 mL0.55mol?L-1 NaOH溶液反应,与用50mL 0.50mol?L-1 盐酸和50ml 0.55mol?L-1 NaOH溶液反应所求中和热的数值相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
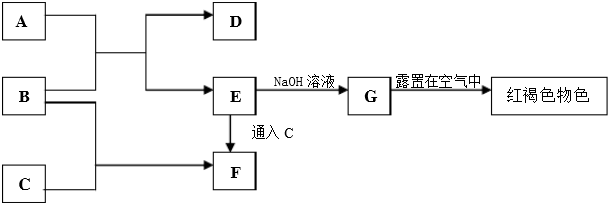
科目:高中化学 来源: 题型:
| A、在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿 |
| B、常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C、亚硫酸氢钠溶液显酸性:NaHSO3=Na++H++SO32- |
| D、对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
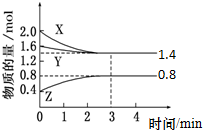 t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )
t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )| A、0~3 min,X的平均反应速率v(X)=0.1 mol?L-1?min-1 |
| B、发生反应的方程式可表示为:3 X(g)+Y(g)?2 Z(g) |
| C、3 min 时,Y的转化率为12.5%,此时,充入惰性气体Ne,转化率不变 |
| D、温度不变,增大Z的浓度,该反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
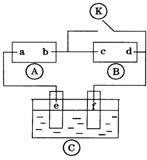 如图
如图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀铜,接通
上的c点显红色.为实现铁上镀铜,接通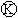 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A、a为直流电源的负极 |
| B、d极发生的反应为2H++2e-=H2↑ |
| C、f电极为铜板 |
| D、e极发生的反应为Cu-2e-=Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com