
| ① | |||||||||||||||||
| ④ | ⑤ | ⑥ | |||||||||||||||
| ② | ③ | ⑦ | |||||||||||||||
| Fe | |||||||||||||||||
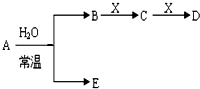



科目:高中化学 来源: 题型:
| A、胶体的丁达尔现象 |
| B、胶体的布朗运动 |
| C、胶体的电泳 |
| D、渗析 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B位于元素周期表中第三周期,IVA族 |
| B、在元素A同主族元素的氢化物中,A的氢化物沸点最高 |
| C、A与B形成的化合物工业上可用作制玻璃的原料 |
| D、A与B形成的化合物不能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g铜片和含0.2mol溶质的18.4mol?L-1浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g铜片和含0.2mol溶质的18.4mol?L-1浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)| 序号 | 不合理的原因 | 误差 (偏低或偏高) |
改变措施 |
| 方案① | |||
| 方案② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 点燃 |
| 乙烷 | 丙烷 | 丁烷 | |
| 熔点/℃ | -183.8 | -189.7 | -138.4 |
| 沸点/℃ | -88.6 | -42.1 | -0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外层数之和为10;B的化合物种类繁多,数目庞大.C、D是空气中含量最多的两种元素;D、E两单质可以生成两种不同的离子化合物.
短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外层数之和为10;B的化合物种类繁多,数目庞大.C、D是空气中含量最多的两种元素;D、E两单质可以生成两种不同的离子化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com