
| ||
| ||
| 点燃 |
| 乙烷 | 丙烷 | 丁烷 | |
| 熔点/℃ | -183.8 | -189.7 | -138.4 |
| 沸点/℃ | -88.6 | -42.1 | -0.5 |
| ||
| ||
| 点燃 |


科目:高中化学 来源: 题型:
| A、AlCl3和NaAlO2 |
| B、FeCl3和FeCl2 |
| C、NaOH和Na2CO3 |
| D、KCl和KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10 mL 5mol?L-1的A溶液加水配制成100 mL溶液 |
| B、9.2 g B物质(式量为46)溶于水配成100mL溶液 |
| C、1.806×1023个C的分子溶于水配成100 mL溶液 |
| D、0.1 moL D物质溶于100 mL 2.5 mol?L-1的D溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一个密闭容器,中间有一可自由滑动的隔板(厚度或忽略),将容器分成两部分.当左边充入1molN2,右边充入CO和CO2的混合气体共9g时,隔板处于如图位置(左、右两侧温度相同),求混合气体中CO和CO2的分子个数比.
一个密闭容器,中间有一可自由滑动的隔板(厚度或忽略),将容器分成两部分.当左边充入1molN2,右边充入CO和CO2的混合气体共9g时,隔板处于如图位置(左、右两侧温度相同),求混合气体中CO和CO2的分子个数比.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | |||||||||||||||||
| ④ | ⑤ | ⑥ | |||||||||||||||
| ② | ③ | ⑦ | |||||||||||||||
| Fe | |||||||||||||||||
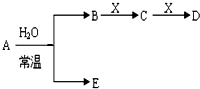

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com