
【题目】聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面具有很好的应用前景。PPG的一种合成路线如图所示:
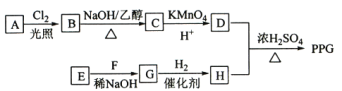
已知:①烃A的相对分子质量为70,其一氯代物只有一种;
②化合物B为单氯代烃;C的分子式为C5H8;
③E、F为相对分子质量差14的同系物;
④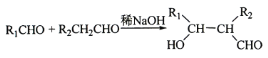 。
。
回答下列问题:
(1)A的结构简式为__________________。
(2)由B生成C的化学方程式为_____________________________________________________。
(3)C的化学名称为___________________,由E和F生成G的反应类型为___________________。由D和H生成PPG的化学方程式为_________________________________。
(4)请写出两种D的同分异构体中能同时满足下列条件的结构简式___________、__________:
①能与饱和NaHCO3溶液反应产生气体;②既能发生银镜反应,又能发生水解反应;
(5)写出以分子式为C5H8的烃为主要原料,制备有机物M( )的合成路线流程图(无机试剂任选)。
)的合成路线流程图(无机试剂任选)。
(合成路线常用的表示方式为:![]() )________________
)________________
【答案】![]()
![]() 环戊烯 加成反应
环戊烯 加成反应 ![]()
![]()
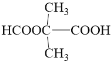 、
、![]() HCOOCH2CH2CH2COOH
HCOOCH2CH2CH2COOH 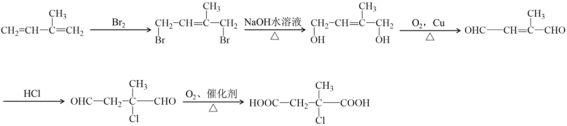
【解析】
根据流程图及题干信息可推断,D是戊二酸,H是丙二醇,烃A的相对分子质量为70,其一氯代物只有一种,则A是环戊烷,结构简式为:![]() ,B是:
,B是: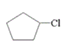 ,B→C发生消去反应,C的结构简式是:
,B→C发生消去反应,C的结构简式是:![]() ,C至D被氧化为酸,故D为:
,C至D被氧化为酸,故D为:![]() ;根据信息③④,可推断出E、F是甲醛、乙醛,G为:
;根据信息③④,可推断出E、F是甲醛、乙醛,G为:![]() ,H为:
,H为:![]() 。
。
(1)由分析可知,A的结构简式为![]() ;
;
(2)由B生成C的化学方程式为:![]() ;
;
(3)C的结构简式是![]() ,化学名称为环戊烯,由E和F生成G的反应为:
,化学名称为环戊烯,由E和F生成G的反应为:![]() ,是加成反应;由D和H生成PPG的化学方程式为
,是加成反应;由D和H生成PPG的化学方程式为![]() ;
;
(4)根据①能与饱和NaHCO3溶液反应产生气体,含羧基,根据②既能发生银镜反应,又能发生水解反应,该物质含甲酯基,两种D的同分异构体有:![]() 、
、![]() 等;
等;
(5)以分子式为C5H8的烃为主要原料,制备有机物M(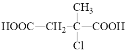 ),类似于该题的图示A
),类似于该题的图示A![]() D的合成路线流程图,合成路线表示为:
D的合成路线流程图,合成路线表示为: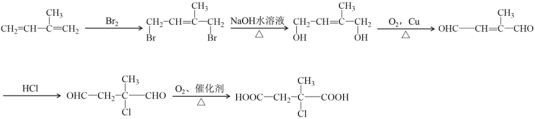 。
。


科目:高中化学 来源: 题型:
【题目】如图所示,用排饱和食盐水法先后收集20mL甲烷和80mL氯气,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象。回答下列问题:
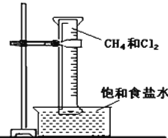
(1)大约30min后,可以观察到量筒内壁出现___________状液体,量筒内液面___________(填“上升”、“下降”或“不变”)。
(2)使1mol甲烷和氯气发生取代反应,生成相同物质的量的四种有机取代物,则需要氯气的物质的量是___________,写出其中常作为有机溶剂和灭火剂的物质的电子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。
(1)某蓄电池反应为2NiO(OH)+Cd+2H2O![]() Cd(OH)2+2Ni(OH)2。该蓄电池充电时,被氧化的物质是__(填化学式),放电时若生成73gCd(OH)2,则外电路中转移的电子数是___。
Cd(OH)2+2Ni(OH)2。该蓄电池充电时,被氧化的物质是__(填化学式),放电时若生成73gCd(OH)2,则外电路中转移的电子数是___。
(2)镍的羰化反应为:Ni(s)+4CO(g)![]() Ni(CO)4(g) ΔH。
Ni(CO)4(g) ΔH。
①一定温度下,将一定量的粗镍和CO加入到1L的恒容密闭容器中反应,5s后测得Ni(CO)4的物质的量为1.5mol,则0~5s内平均反应速率v(CO)=__mol·L·s-1。
②该反应的平衡常数K随温度升高而减小,则该反应的ΔH__0(填“>”或“<")。
(3)NiSO4·6H2O晶体是一种绿色易溶于水的晶体,广泛应用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等元素)为原料制取。制取步骤如下:
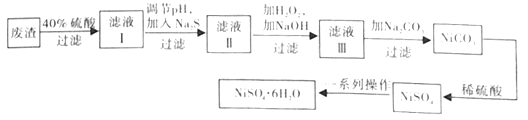
①在实验室中,欲用98%的浓硫酸(密度1.84g·mL-1)配制40%的稀硫酸,需要的玻璃仪器除玻璃棒外,还有__。
②向滤液Ⅰ中加入Na2S的目的是_。(已知:Ksp[FeS]=6.3×10-18,Ksp[CuS]=1.3×10-36,Ksp[ZnS]=1.3×10-24,Ksp[NiS]=1.1×10-21)
③滤液Ⅲ中所含的阳离子主要有__。
④NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为__。
⑤在制备NiSO4·6H2O晶体时,常用无水乙醇代替蒸馏水做洗涤剂,原因是__(写出一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有5种无色液态物质:己烯、己烷、苯、甲苯和苯酚符合下列各题要求的分别是:
(1)不与浓溴水反应但能与KMnO4酸性溶液反应的是_______。
(2)在空气中能被氧化成粉红色,该物质是_______。写出该物质与浓溴水反应的化学方程式________。
(3)不能与溴水和KMnO4酸性溶液反应,但在铁屑作用下能与液溴反应的是____,反应的化学方程式为________,此反应属于______反应。
(4)既能与溴水又能与KMnO4酸性溶液反应的烃是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活生产密切相关。下列说法中不正确的是
A. 施肥时,铵态氮肥不能与草木灰(含K2CO3)混合使用
B. 夏天冰箱保鲜食品的原理是降低温度,减小化学反应速率
C. 施用适量石膏(CaSO4·2H2O)可降低盐碱地(含较多NaCl、Na2CO3)的碱性
D. 将海水直接电解可获得 Mg及Cl2等单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我省盛产矿盐(主要成分是NaCl,还好有SO42-等其他可溶性杂质的离子)。下列有关说法正确的是
A. 有矿盐生成食盐,除去SO42-最合适的实际是Ba(NO3)2
B. 工业上通过电解氯化钠溶液制备金属钠和氯气
C. 室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D. 用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种可再生绿色新能源,被誉为“21世纪的清洁燃料”。
(1)写出二甲醚一种同分异构体的结构简式:____________。
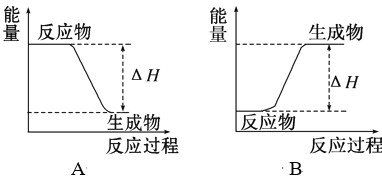
(2)CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)是____________反应(填“吸热”或“放热”),该反应过程的能量变化示意图可用下图中的____________表示(填“A”或“B”)。
(3)工业上可用水煤气合成二甲醚:2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)
①测得CO和CH3OCH3(g)的浓度随时间变化如图所示,则反应开始至平衡时CO的平均反应速率v(CO)=________mol/(L·min)。
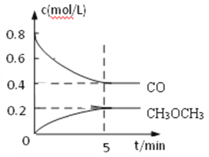
②该反应在恒容密闭容器中进行,下列叙述中能表示该反应达到平衡状态的是____________。
A.单位时间内生成CO和H2的物质的量之比为1﹕2
B.CH3OCH3的浓度不再变化
C.容器内压强不再变化
D.CH3OCH3与H2O的物质的量相等
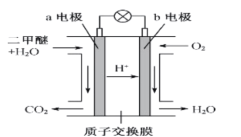
(4)二甲醚燃料电池工作原理如图所示,则a电极的电极名称为____________极(填“正”或“负”)。
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像与描述相符的是( )
A.图1是C(s)+H2O(g)![]() CO(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0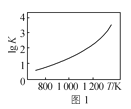
B.图2表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化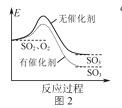
C.图3是室温下AgCl和AgI的饱和溶液中离子浓度的关系曲线,说明该温度下反应AgCl(s)+I-(aq)![]() AgI(s)+Cl-(aq)的平衡常数K=2.5×106
AgI(s)+Cl-(aq)的平衡常数K=2.5×106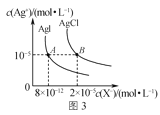
D.图4表示向BaCl2溶液中滴加稀硫酸至过量的过程中溶液导电性的变化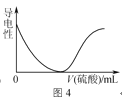
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com