
【题目】钛被称为继铁、铝之后的第三金属,其单质及化合物在航天、军事、航海、医疔等领域都有着重要的应用。请回答下列问题:
(1)基态Ti原子的价电子轨道表示式为___________。
(2)化学式为[Ti(H2O)6]Cl3的绿色晶体是TiCl3的六水合物的一种晶型,该晶体中,与Ti3+形成配位键的原子是___________ (填元素符号),该原子的杂化类型为___________杂化,该晶体所含元素中,电负性最大的元素是___________ (填元素符号)。
(3)化学式为[Ti(H2O)5 Cl]Cl2·H2O的绿色晶体是TiCl3的六水合物的另一种晶型,取1mol该晶体溶于水配成500mL溶液,加入足量AgNO3溶液使Cl-完全沉淀,消耗AgNO3的物质的量为___________mol。
(4)钛与卤素形成的化合物的熔沸点如下表所示,

TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是______________________。
(5)TiO2能溶浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如下图所示,阳离子化学式为___________,写出一种与SO42-互为等电子体的分子___________。

(6)下图是钛晶体在空间的一种堆积方式,此堆积方式名称为___________,钛原子的配位数为__________。已知:a=0.295nm,c=0.469nm,则该钛晶体的密度为___________g·cm-3(NA表示阿伏加德罗常数的值,列出计算式即可)。

【答案】![]() O sp3 O 2 TiCl4、TiBr4、TiI4都是分子晶体,而且组成和结构相似,其相对分子质量依次增大,分子间作用力逐渐增大,因而三者的熔点和沸点依次升高 (TiO)n2n+ 或(TiO2+) CCl4 SiCl4等 六方最密堆积 12 48×6/[
O sp3 O 2 TiCl4、TiBr4、TiI4都是分子晶体,而且组成和结构相似,其相对分子质量依次增大,分子间作用力逐渐增大,因而三者的熔点和沸点依次升高 (TiO)n2n+ 或(TiO2+) CCl4 SiCl4等 六方最密堆积 12 48×6/[![]() ×(2.95×10-8)2×4.69×10-8NA]
×(2.95×10-8)2×4.69×10-8NA]
【解析】
(1)根据基态Ti原子的价电子为3d24s2,画出其价电子轨道表示式;
(2) [Ti(H2O)6]Cl3晶体中,与Ti3+形成配位键的原子是O,O原子的杂化类型为sp3;晶体所含元素中,电负性最大的元素是O。
(3)取1mol绿色晶体[Ti(H2O)5Cl]Cl2·H2O溶于水配成500mL溶液,溶液中含有2mol氯离子,据此进行计算;
(4)组成和结构相似的分子晶体,其相对分子质量依次增大,分子间作用力逐渐增大,熔沸点越高;
(5) Ti与O的个数比为1:1,化学式为(TiO)n2n+ (TiO2+);SO42-中的S属于sp3杂化,SO42-原子总数为5,价层电子总数为32,据此规律写出与其互为等电子体的分子;
(6)由钛为六方最密堆积,钛原子的配位数为12;该结构中含有的钛原子个数为6个,质量为48×6/NAg;求出该结构的体积Vcm3;根据公式ρ=m/V计算出该晶体的密度。
(1)钛原子的核电荷数为22,其基态原子核外电子排布为:1s22S22p63s23p63d24s2,其价电子为3d24s2,价电子轨道表示式为![]() ;
;
综上所述,本题答案是:![]() 。
。
(2)化学式为[Ti(H2O)6]Cl3的绿色晶体是TiCl3的六水合物的一种晶型,该晶体中,与Ti3+形成配位键的原子是O,O原子形成2个σ键和2对孤电子对,该原子的杂化类型为sp3;同一周期,从左到右,电负性增大,同一主族,从上到下,电负性减小,因此该晶体所含元素中,电负性最大的元素是O。
综上所述,本题答案是:O,sp3 ,O。
(3)化学式为[Ti(H2O)5Cl]Cl2·H2O的绿色晶体是TiCl3的六水合物的另一种晶型,取1mol绿色晶体溶于水配成500mL溶液,溶液中含有2mol氯离子,加入足量AgNO3使Cl-完全沉淀,消耗AgNO3的物质的量为2mol。
综上所述,本题答案是:2。
(4) 从表中数据可知,TiCl4、TiBr4、TiI4三种卤代物的熔点沸点随着相对分质量的增大而增大,原因是TiCl4、TiBr4、TiI4都是分子晶体,而且组成和结构相似,其相对分子质量依次增大,分子间作用力逐渐增大,因而三者的熔点和沸点依次升高;
综上所述,本题答案是:TiCl4、TiBr4、TiI4都是分子晶体,而且组成和结构相似,其相对分子质量依次增大,分子间作用力逐渐增大,因而三者的熔点和沸点依次升高。
(5) Ti与O的个数比为1:1,化学式为(TiO)n2n+ (或TiO2+),SO42-中的S的σ电子对数为4,无孤对电子,故价层电子对数为4,属于sp3杂化;SO42-原子总数为5,价层电子总数为32,与其互为等电子体的分子为CCl4、SiCl4等。
综上所述,本题答案是:(TiO)n2n+ (或TiO2+) ,CCl4、SiCl4等。
(6)由钛的空间堆积方式可知其为六方最密堆积,钛原子的配位数为12;该结构中含有的钛原子个数为6个,质量为48×6/NAg;该结构的体积为:[![]() ×(2.95×10-8)2×4.69×10-8]cm3;则该晶体的密度为:48×6/[
×(2.95×10-8)2×4.69×10-8]cm3;则该晶体的密度为:48×6/[![]() ×(2.95×10-8)2×4.69×10-8NA] g·cm-3;
×(2.95×10-8)2×4.69×10-8NA] g·cm-3;
综上所述,本题答案是:六方最密堆积,12,48×6/[![]() ×(2.95×10-8)2×4.69×10-8NA]。
×(2.95×10-8)2×4.69×10-8NA]。


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】下列关于硅的说法不正确的是( )
A.硅在地壳中的含量仅次于氧
B.硅在自然界中既有化合态,又有游离态
C.硅是人类将太阳能转换为电能的常用材料
D.硅单质的导电能力介于导体和绝缘体之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属及其化合物的说法正确的是
A.铝和氢氧化钠溶液反应生成Al(OH)3和H2O
B.钠在空气中燃烧生成淡黄色的Na2O
C.铁在高温下与水蒸气反应生成Fe2O3和H2
D.碳酸钠溶液和氢氧化钙溶液反应生成NaOH和CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种工业盐,在生产、生活中应用广泛,外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒。某学习小组通过如下装置(夹持及加热装置略去)制取NaNO2样品并对样品含量进行测定
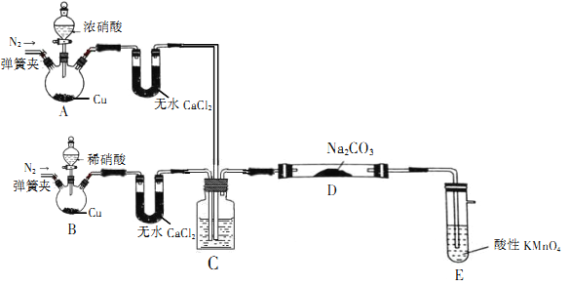
该小组先查阅资料知:NO、NO2能被酸性高锰酸钾氧化为NO3-。
(1)装置A中用于盛放浓硝酸的仪器名称为__________,装置D中发生的化学反应方程式为___________。
(2)①装置C中所装的液体需满足的条件是____________________。
②其作用为____________________。
(3)装置E的作用是____________________。
(4)为测定制得样品中NaNO2的含量,该实验中需配制KMnO4标准溶液并酸化,应选择__________(填化学式)来酸化KMnO4溶液。
(5)已知:在酸性溶液中,NO2-可将MnO4-还原为Mn2+。为测定样品中亚硝酸钠的含量,该小组称取4.0g样品溶于水配制成250mL溶液,取25.00mL溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液进行滴定,消耗20.00mL酸性KMnO4溶液(杂质不反应)。滴定过程中酸性KMnO4溶液的作用是____________________,所得样品中NaNO2的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 在A1C13溶液中逐滴滴入NaOH溶 液至过量,然后通入CO2气体 | 先出现白色沉淀,后沉淀消失,最后又出现白色沉淀 | Al(OH)3是两性氢氧化物,但不能溶解在某些弱酸中 |
B | 向浓度均为0.1mol/L的MgCl2、 CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | 向Na2CO 3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中 | 产生白色浑浊 | 酸性:盐酸>碳酸>硅酸 |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在I3- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯酚的叙述中,正确的是 ( )
A.纯净的苯酚是粉红色晶体B.苯酚不溶于水
C.苯比苯酚容易发生苯环上的取代反应D.可用浓溴水鉴别苯和苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)烷烃分子可看成由—CH3、—CH2—、![]() 和
和![]() 等结合而成的。试写出同时满足下列条件的烷烃的结构简式:___________ ,此烷烃可由烯烃加成得到,则该烯烃可能有___________种。
等结合而成的。试写出同时满足下列条件的烷烃的结构简式:___________ ,此烷烃可由烯烃加成得到,则该烯烃可能有___________种。
① 分子中同时存在上述4种基团;② 分子中所含碳原子数最少;
③ 该烷烃的一氯代物同分异构体的数目最少。
(2)碳原子数为8的单烯烃中,与HBr加成产物只有一种结构,符合条件的单烯烃有_______种。
(3)已知烯烃通过臭氧氧化并经锌和水处理得到醛或酮。例如:
 CH3CH2CHO+
CH3CH2CHO+
上述反应可用来推断烃分子中碳碳双键的位置。
某烃A的分子式为C6H10,经过上述转化生成![]() ,则烃A的结构可表示为_______________。
,则烃A的结构可表示为_______________。
(4) 请写出 物质与足量的金属钠发生反应的化学方程式_________。
物质与足量的金属钠发生反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的0.2g铜粉与5mL1 molL1FeCl3溶液混合,充分振荡,溶液棕黄色变浅,溶液变绿,有灰白色固体出现。通过查阅资料,初步认为灰白色固体可能含CuCl(CuCl白色晶体,不溶于水、硫酸、稀硝酸,溶于氨水、浓盐酸溶液中,生成络合物)。为进一步探究灰白色固体是否含CuCl,进行一系列实验。已知:① CuCl+2NH3H2O![]() [Cu(NH3)2]++Cl+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液
[Cu(NH3)2]++Cl+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液
请回答下列问题:
(1)生成CuCl的化学方程式____________________________________。
(2)下列为常见的分离装置(装置中的其他仪器忽略),从上述溶液中分离出固体混合物,应选用的相应装置中的仪器名称是_______________。
A. B.
B. 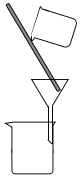 C.
C.![]() D.
D. E.
E. F.
F.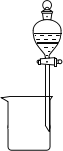
(3)提纯灰白色固体:将固体混合物用蒸馏水洗涤以除去固体表面的Fe3+、Cl。为检验固体混合物是否洗涤干净,最佳方案是检验洗涤液中是否含有_______(填离子符号),理由是_____________________________________________。
(4)设计实验检验得到的灰白色固体中含有CuCl,该实验过程中用到的试剂为____________________。
(5)实验测得灰白色固体混合物质量为a g,其中CuCl b g。上述实验过程中还有CuCl2生成,则生成CuCl2的物质的量是____________(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com