

 .
.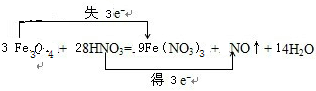 ;
; ;
;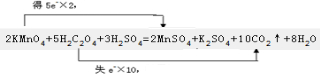 ,故答案为:
,故答案为: ;
; ,故答案为:
,故答案为: .
.


科目:高中化学 来源: 题型:
| A、实验①能够证明Cl-具有还原性 |
| B、上述实验不能证明Fe2+具有氧化性 |
| C、上述实验能够证明氧化性:MnO4->Cl2>Fe3+>I2 |
| D、由上述实验不能判断氯气能使湿润的淀粉KI试纸变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
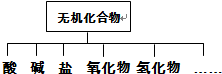
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl ② | ③ ④Ba(OH)2 | ⑤Na2CO3 ⑥ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
| 检测次数 | 溶液中检测出的物质 |
| 第1次 | KCl、K2SO4、Na2CO3、NaCl |
| 第2次 | KCl、BaCl2、Na2SO4、K2CO3 |
| 第3次 | Na2SO4、KCl、K2CO3、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和滴定实验时,用待测液润洗锥形瓶 |
| B、盛放NaOH溶液时,使用带玻璃瓶塞的磨口瓶 |
| C、在用PH试纸测溶液的pH值时,用镊子夹取试纸伸到试剂瓶中取液,将颜色与标准比色卡对照,读出数值 |
| D、向纯碱溶液加入酚酞,溶液显红色,将该溶液加热,则红色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A的转化率变小 |
| B、平衡向逆反应方向移动 |
| C、D的质量百分数变大 |
| D、a<c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com