
【题目】足量锌与浓H2SO4充分在加热下反应生成会SO2和H2的混合气体;锌和稀硫酸反应只有H2生成。现有甲乙两研究小组分别实验探究:
甲研究小组按下图实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL 18.5mol·L-1的浓硫酸,经过一段时间反应,Zn完全溶解
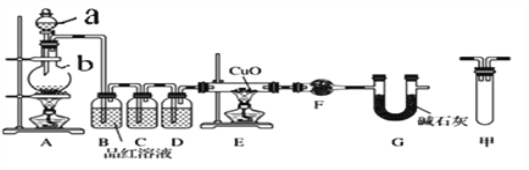
(1)填写仪器名称:a_______________。
(2)写出装置A中生成能使品红溶液褪色的化学反应方程式:_________________。
(3)装置D中加入的试剂是__________。
(4)U型管G的作用为______________。
(5)有同学认为A、B间应增加图中的甲装置,该装置的作用为__________。
(6)证明反应生成SO2和H2的实验现象是_________________。
(7)若A中生成标准状况下的气体33.6L,将A反应后的溶液稀释到1L,测得溶液中H+的浓度为0.1 mol·L-1,则稀释液中SO42-的物质的量浓度是_________ mol·L-1
【答案】分液漏斗Zn+2H2SO4(浓)![]() ZnSO4+2H2O+SO2↑浓硫酸防止空气中的水蒸气进入干燥管,干扰实验防止倒吸B中品红褪色,E中有红色物质生成且F中的无水硫酸铜变蓝1.55 mol·L-1
ZnSO4+2H2O+SO2↑浓硫酸防止空气中的水蒸气进入干燥管,干扰实验防止倒吸B中品红褪色,E中有红色物质生成且F中的无水硫酸铜变蓝1.55 mol·L-1
【解析】
A是制取气体的装置,制备的气体中有二氧化硫、氢气、水蒸汽,B装置是除去二氧化硫,可以用氢氧化钠等碱液吸收;C装置是检验二氧化硫是否除尽,D装置是浓硫酸,吸水干燥作用;E装置是用还原性气体还原氧化铜,F装置无水硫酸铜,检验是否有水生成;G是防止空气中H2O进入干燥管而影响杂质气体的检验。
(1)结合仪器图形和作用得到名称;
(2)装置A中生成能使品红溶液褪色的气体为二氧化硫,是锌和浓硫酸反应得到硫酸锌、二氧化硫和水;
(3)③是对气体进行干燥的试剂为浓硫酸;
(4)G是防止空气中H2O进入干燥管而影响杂质气体的检验;
(5)A、B间应增加图中的甲装置是安全瓶;
(6)B装置是检验二氧化硫,B中品红褪色,证明反应生成SO2;E装置是用还原性气体还原氧化铜,F装置无水硫酸铜,检验是否有水生成;
(7)反应后的溶液稀释到1L,测得氢离子浓度为0.1mol·L-1,稀释后硫酸的浓度为0.05mol·L-1,反应剩余的硫酸为0.05mol×1L=0.05mol,则反应后溶液中硫酸的物质的量浓度为0.05mol×1L/0.1L=0.5mol·L-1,为稀硫酸,故发生反应:Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+H2O、Zn+H2SO4=ZnSO4+H2↑,生成的气体为SO2、H2混合气体,令混合气体中SO2、H2的物质的量分别为xmol、ymol,根据二者体积与消耗硫酸的物质的量列方程计算;
ZnSO4+SO2↑+H2O、Zn+H2SO4=ZnSO4+H2↑,生成的气体为SO2、H2混合气体,令混合气体中SO2、H2的物质的量分别为xmol、ymol,根据二者体积与消耗硫酸的物质的量列方程计算;
(1)①装置图中仪器a为分液漏斗;
(2)装置A中生成能使品红溶液褪色的气体为二氧化硫,是锌和浓硫酸反应得到硫酸锌、二氧化硫和水;
(3)D装置是浓硫酸,吸水干燥作用,
(4)G装置中的碱石灰是防止空气中H2O进入干燥管而影响杂质气体的检验,干扰实验,
(5)A、B间应增加图中的甲装置,是为了防止B装置中的液体倒吸
(6)B装置是检验二氧化硫,B中品红褪色,证明反应生成SO2;E装置是用还原性气体还原氧化铜,F装置无水硫酸铜,检验是否有水生成,只要黑色变红色,无水硫酸铜变蓝色,证明反应生成氢气;
(7)反应后的溶液稀释到1L,氢离子浓度为0.1mol·L-1,稀释后硫酸的浓度为0.05mol·L-1,则反应后溶液中硫酸的物质的量浓度为0.05mol×1L/0.1L=0.5mol·L-1,为稀硫酸,故发生反应:Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+H2O、Zn+H2SO4=ZnSO4+H2↑,生成的气体为SO2、H2混合气体,物质的量为=33.6L/22.4L·mol-1=1.5mol,参加反应的n(H2SO4)=0.1L×18.5mol·L-1-0.05mol×1L=1.8mol,令混合气体中SO2、H2的物质的量分别为xmol、ymol,则:
ZnSO4+SO2↑+H2O、Zn+H2SO4=ZnSO4+H2↑,生成的气体为SO2、H2混合气体,物质的量为=33.6L/22.4L·mol-1=1.5mol,参加反应的n(H2SO4)=0.1L×18.5mol·L-1-0.05mol×1L=1.8mol,令混合气体中SO2、H2的物质的量分别为xmol、ymol,则:
Zn+2H2SO4((浓)![]() ZnSO4+SO2↑+H2O
ZnSO4+SO2↑+H2O
x 2x x
Zn+H2SO4(稀)=ZnSO4+H2↑
y y y
x+y=1.5
2x+y=1.8
解之得 x=0.3,y=1.2
根据原子守恒反应后溶液中SO42- 为n(浓硫酸)-n(SO2)=0.1L×18.5mol·L-1-0.3mol=1.55mol.


科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2SO2(g)+O2 ![]() 2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
B. 已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C. 已知H+(aq)+OH-(aq)=H2O(1),△H=-57.3kJ/mol,则任何酸碱中和反应的热效应均为57.3 kJ
D. 已知2C(s)+2O2(g)=2CO2(g) △H1,2C(s)+O2(g)=2CO(g) △H2 则△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①C(s)+O2(g)=CO2(g);ΔH=![]() 393.5kJ/mol
393.5kJ/mol
②2CO(g) +O2(g)=2CO2(g);ΔH=![]() 566kJ/mol
566kJ/mol
③CaCO3(s)=CaO(s)+CO2(g);ΔH=![]() 177.7kJ/mol
177.7kJ/mol
④0.5H2SO4(l) +NaOH(l)=0.5Na2SO4(l)+H2O(l);ΔH=![]() 57.3kJ/mol
57.3kJ/mol
⑤HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l);ΔH=![]() 57.3kJ/mol
57.3kJ/mol
(1)上述热化学方程式中,不正确的有___________________(填序号,以下同);
(2)上述反应中,表示燃烧热的热化学方程式是___________________________________;上述反应中,表示中和热的热化学方程式是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是

A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某草酸(H2C2O4)溶液的浓度,进行如下实验:
取25.00mL某草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为0.10molL-1的KMnO4溶液滴定到终点,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O试回答:
(1)实验中,标准液KMnO4溶液应装在________式滴定管中,因为_____________;
(2)实验中眼睛注视_________________,直至滴定终点;判断到达终点的现象是___________________________________________ ;
(3)若实验所用KMnO4溶液体积为21.00mL,则草酸溶液的浓度为_______________;
(4)实验中,下列操作(其它操作均正确),会对所测草酸浓度有什么影响?(填偏大、偏小、无影响)
A.滴定前仰视刻度,滴定后俯视刻度________________________;
B.锥形瓶在盛放待测液前未干燥,有少量蒸馏水______________________________;
C.滴定过程中摇动锥形瓶,不慎将瓶内的溶液溅出一部分______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中:C元素的原子最外层电子数是次外层电子数的三倍;A与D、C与F同主族;D是所在周期原子半径最大的主族元素,又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置________________。
(2)写出B单质的电子式________________。
(3)C、D、F三种元素形成的简单离子的半径由大到小的顺序是________(用离子符号表示)。
(4)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有_________________________。
(5)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:________________________________________________;若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:______________________________________________。
(6)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,反应H2(g)+I2(g)![]() 2HI(g)达到化学平衡状态的标志是
2HI(g)达到化学平衡状态的标志是
A. 单位时间内生成nmolH2,同时就有nmolHI 生成
B. 单位时间内有nmolH2生成,同时就有nmolI2生成
C. 容器内气体的总压强不随时间的变化而变化
D. 容器内混合气体的颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A. υ(A)=0.3mol/(L·min) B. υ(B)=0.6mol/(L·min)
C. υ(C)=0.5mol/(L·min) D. υ(D)=0.4mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com