
【题目】氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸的流程示意图。
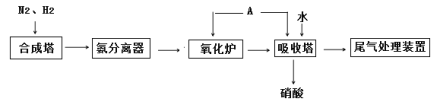
(1)写出合成塔中发生反应的化学方程式____________________,
(2)写出氧化炉中发生反应的化学方程式____________________
(3)A物质为______,向吸收塔中通入A的作用__________
(4)工业生产中为了盛装大量浓硝酸,可选择___作为罐体材料
A. 铜 B.铂 C.铝 D.镁
(5)为避免尾气氮氧化物污染环境,人们开发了溶液吸收、催化还原等尾气处理方法。前者使用具有碱性的Na2CO3溶液等吸收尾气,后者在催化下使用NH3或其他物质将氮氧化物还原为N2。请以尾气中的NO2处理为例,写出相关反应的化学方程式____________、_____________。
【答案】N2+3H2 ![]() 2NH3 4NH3+5O2
2NH3 4NH3+5O2![]() 4NO+6H2O 空气(氧气) 促进NO转化为NO2 C O2+4NO2+2Na2CO3=2CO2+4NaNO3 (或 2NO2+Na2CO3=NaNO3+NaNO2+CO2)
4NO+6H2O 空气(氧气) 促进NO转化为NO2 C O2+4NO2+2Na2CO3=2CO2+4NaNO3 (或 2NO2+Na2CO3=NaNO3+NaNO2+CO2) ![]()
【解析】
氮气和氢气进入合成塔催化剂高温高压反应生成氨气,进入氨分离器,从氨分离器中又回到合成塔中的物质是N2和H2,氨气进入氧化炉中发生反应为氨气的催化氧化,进入吸收塔,通入空气使NO2和NO全部转化为HNO3,得到尾气中的少量NO、NO2可以用NH3来处理,据此分析解答。
(1) 氮气和氢气进入合成塔催化剂高温高压反应生成氨气,合成塔中发生反应的化学方程式:N2+3H2 ![]() 2NH3;
2NH3;
(2) 氨气进入氧化炉中发生反应为氨气的催化氧化,反应中N元素化合价由NH3中3价升高为NO中+2价,共升高5价,O元素由O2中0价降低为2价,共降低4价,化合价升降最小公倍数为20,故NH3系数为4,故O2系数为5,利用元素守恒平衡可知NO系数为4,H2O的系数为6,化学方程式为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(3)氧化炉中出来的气体,先降温再进入吸收塔,吸收塔中通入空气发生反应2NO+O2=2NO2;4NO+3O2+2H2O=4HNO3;4NO2+O2+2H2O=4HNO3,所以通入空气作用为使NO2和NO全部转化为HNO3,A物质为氧气或空气,向吸收塔中通入A的作用是促进NO转化为NO2;
(4)铝与浓硝酸会发生钝化,工业生产中为了盛装大量浓硝酸,可选择铝作为罐体材料,浓硝酸有强氧化性,铜、铂、镁等大多数金属都会与浓硝酸反应,所以不能使用;
(5) 根据题中信息,使用具有碱性的Na2CO3溶液等吸收尾气,化学方程式为:O2+4NO2+2Na2CO3=2CO2+4NaNO3 (或 2NO2+Na2CO3=NaNO3+NaNO2+CO2);NO2和NH3反应生成氮气和水,反应的化学方程式为:![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol·L1的NaOH溶液分别滴定均为20.00mL0.100mol·L1的HCl溶液和醋酸溶液,滴定曲线如图所示。下列说法正确的是
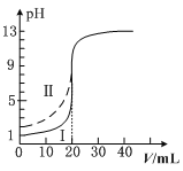
A.Ⅰ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)>20.00mL
C.V(NaOH)=20.00mL时,两份溶液中c(Cl-)>c(CH3COO-)
D.V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃是一类简单的有机化合物。
(1)天然气属于______________(填“纯净物”或“混合物”),其组成以__________为主。该分子的电子式是_____________,其空间结构是_____________________。
(2)烷烃随着碳原子数的增多,沸点逐渐________(填“升高”或“降低”),碳原子数≤________的烷烃呈气态,它们和氯气发生取代反应的条件是________________。
(3)2,2,3-三甲基丁烷的结构简式是____________________________________,其一氯代物有_______种,该烷烃与正庚烷互为__________________________(填“同系物”或“同分异构体”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
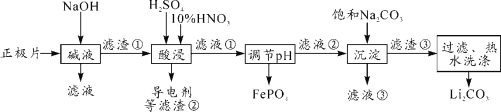
(1)“碱溶”时Al箔溶解过程中,氧化剂是______________。
(2)“酸浸”时生成NO的离子方程式是_________。(其他杂质不与HNO3反应)
(3)实验测得滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3溶液后,Li+的沉降率为90%,则加入饱Na2CO3 溶液中c(Na2CO3)=______ mol·L-1。[Ksp(Li2CO3)=1.6×10-3]
(4)磷酸亚铁锂电池总反应为:LiFePO4+6C![]() Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,该电池的负极接电源的_____(填“正极”或“负极”);放电时,正极反应式为_______。
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,该电池的负极接电源的_____(填“正极”或“负极”);放电时,正极反应式为_______。
(5)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取1.20g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.020mol·L-1重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
①实验中加入HgCl2饱和溶液的目的是_________。
②磷酸亚铁锂电池中铁的含量为________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
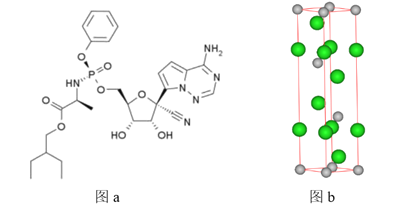
【题目】瑞德西韦(Remdesivir)是一种核苷类似物,具有抗病毒活性,对新型冠状病毒(2019-nCoV)病例展现出较好的疗效。其结构如图a所示,回到下列问题:
(1)该结构中P原子价电子的轨道表示式为_________。
(2)该结构中处于第二周期原子第一电离能从大到小的顺序为_______(用化学用语回答)。
(3)该结构氨基中N的杂化方式为_________,该分子间的作用力有________。
(4)苯酚(C6H5OH)为合成反应物之一,苯酚的晶体类型是_________,与甲苯(![]() )的相对分子质量相近,但苯酚的熔沸点高于甲苯,原因是________。
)的相对分子质量相近,但苯酚的熔沸点高于甲苯,原因是________。
(5)某镨(59Pr)的化合物是合成该分子的催化剂之一,则镨元素位于元素周期表中的__________区。MgCl2也是合成瑞德西韦的催化剂,晶胞如图b所示,则Mg2+处于氯离子围成的___________空隙中。晶胞参数为acm、acm、bcm,则该晶体的密度为_____________g/cm3。(填表达式,已知底面夹角分别为120°、60°,侧面与底面垂直)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有a mol FeI2的溶液中,通入x mol Cl2。下列各项为通入Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
A. x≤a,2I+Cl2=I2+2Cl
B. x=1.2a,10Fe2++14I+12Cl2=10Fe3++7I2+24Cl
C. x=1.4a,4Fe2++10I+7Cl2=4Fe3++5I2+14Cl
D. x≥1.5a,2Fe2++4I+3Cl2=2Fe3++2I2+6Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同,且SO42-物质的量浓度为6 mol/L,则此溶液最多溶解铁粉的质量为( )
A.11.2 gB.16.8 gC.19.6 gD.22.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯胺(![]() )是重要的化工原料。某兴趣小组在实验室里制取并纯化苯胺。
)是重要的化工原料。某兴趣小组在实验室里制取并纯化苯胺。
已知:①![]() 与NH3相似,与盐酸反应生成
与NH3相似,与盐酸反应生成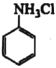 (易溶于水的盐)。
(易溶于水的盐)。
②用硝基苯制取苯胺的反应为:2![]() +3Sn+12HCl
+3Sn+12HCl![]() 2
2![]() +3SnCl4+4H2O
+3SnCl4+4H2O
③有关物质的部分物理性质见下表:
物质 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度/g·cm-3 |
苯胺 | 93 | 6.3 | 184 | 微溶于水,易溶于乙醚 | 1.02 |
硝基苯 | 123 | 5.7 | 210.9 | 难溶于水,易溶于乙醚 | 1.23 |
乙醚 | 74 | 116.2 | 34.6 | 微溶于水 | 0.7134 |
Ⅰ.制备苯胺
图1所示装置中加入20mL浓盐酸(过量),置于热水浴中回流20min,使硝基苯充分还原;冷却后,向三颈烧瓶中滴入一定量50%NaOH溶液,至溶液呈碱性。
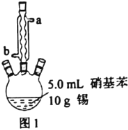
(1)滴加适量NaOH溶液的目的是___,写出主要反应的离子方程式___。
ⅰ.取出图l所示装置中的三颈烧瓶,改装为图2所示装置。加热装置A产生水蒸气。用“水蒸气蒸馏”的方法把B中苯胺逐渐吹出,在烧瓶C中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液甲。
ⅱ.向所得水溶液甲中加入氯化钠固体至饱和,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用NaOH固体干燥,蒸馏后得到苯胺1.86g。
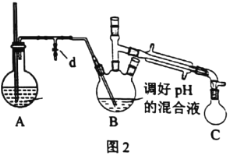
(2)装置A中玻璃管的作用是__。
(3)在苯胺吹出完毕后,应进行的操作是先__,再___。
(4)该实验中苯胺的产率为___(保留三位有效数字)。
(5)欲在不加热条件下除去苯胺中少量的硝基苯杂质,简述实验方案___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种性能非常优越的金属,21世纪将是钛的世纪。
(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Cr原子的核外电子排布式为____。
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为____
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是_____;
③NH4Cl中存在的作用力有_____,NH4Cl熔沸点高于CH3CH2OH的原因是_____,Ti(OCH2CH3)4分子中C原子的杂化形式均为 ____。
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于____位置;已知晶胞参数为a nm,Ti位于O所形成的正八面体的体心,则该八面体的边长为_____ m(列出表达式)。
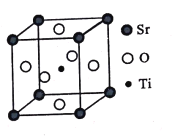
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com